早教吧作业答案频道 -->化学-->
钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:(1)Na2MoO4•2H2O中钼元素的化合价为;(2
题目详情
钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
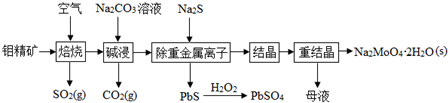
(1)Na2MoO4•2H2O中钼元素的化合价为___;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是___(答出一条即可);
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2
MoO3+SO2(未配平),该反应中氧化产物是___(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为___mol;焙烧中产生的SO2怎样变废为宝___(答出一条即可);
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___;
(5)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因___;
(6)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,
SO42-的去除率为97.5%,已知碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.040mol•L-1,Ksp(BaSO4)=1.0×10-10、则Ksp(BaMoO4)=___[加入Ba(OH)2固体引起的溶液体积变化可忽略].

(1)Na2MoO4•2H2O中钼元素的化合价为___;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是___(答出一条即可);
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2
| △ |
| |
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___;
(5)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因___;
(6)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,
SO42-的去除率为97.5%,已知碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.040mol•L-1,Ksp(BaSO4)=1.0×10-10、则Ksp(BaMoO4)=___[加入Ba(OH)2固体引起的溶液体积变化可忽略].
▼优质解答
答案和解析
(1)计算结晶水合物钼钼酸钠中元素的化合价只计算Na2MoO4中钼元素的化合价即可,钠元素显+1,氧元素显-2,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可知钼酸钠(Na2MoO4•2H2O)中钼元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,
故答案为:+6;
(2)反应物接触时间越长,反应越充分,焙烧的过程中采用“逆流焙烧”的措施、粉碎矿石或增加空气通入量等,增大钼精矿与空气接触,使其充分反应,提高原料的利用率,
故答案为:将矿石粉碎(或增加空气的进入量或采用逆流原理等);
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2
2MoO3+4SO2,元素化合价升高的失去电子发生氧化反应得到氧化产物,反应中Mo元素化合价+2价变化为+6价,硫元素化合价-1价变化为+4价,该反应中氧化产物是MoO3、SO2,反应中生成4mol二氧化硫电子转移28mol,则生成1mol二氧化硫电子转移为7mol,二氧化硫可以催化氧化生成三氧化硫,溶于水生成硫酸,焙烧中产生的SO2在工业制硫酸中做原料气变废为宝,
故答案为:MoO3、SO2;7;工业制硫酸的原料气;
(4)碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠,离子方程式为MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(5)由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理,
故答案为:使用多次后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(6)当BaMoO4开始沉淀时溶液中钡离子浓度c(Ba2+)=
=
,
溶液中硫酸根离子浓度c(SO42-)=
,
SO42-的去除率为97.5%,1-
=97.5%
1-
=97.5%
Ksp(BaMoO4)=4.0×10-8,
故答案为:4.0×10-8.
故答案为:+6;
(2)反应物接触时间越长,反应越充分,焙烧的过程中采用“逆流焙烧”的措施、粉碎矿石或增加空气通入量等,增大钼精矿与空气接触,使其充分反应,提高原料的利用率,
故答案为:将矿石粉碎(或增加空气的进入量或采用逆流原理等);
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2
| ||
故答案为:MoO3、SO2;7;工业制硫酸的原料气;
(4)碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠,离子方程式为MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(5)由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理,
故答案为:使用多次后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(6)当BaMoO4开始沉淀时溶液中钡离子浓度c(Ba2+)=
| Ksp(BaMnO4) |
| c(MnO4-) |
| Ksp(BaMoO4) |
| 0.4mol/L |
溶液中硫酸根离子浓度c(SO42-)=
| Ksp(BaSO4) |
| c(Ba2+) |
SO42-的去除率为97.5%,1-
| Ksp(BaSO4) |
| c(Ba2+) |
1-
| 1.0×10-10 | ||
|
Ksp(BaMoO4)=4.0×10-8,
故答案为:4.0×10-8.
看了钼酸钠晶体(Na2MoO4•2...的网友还看了以下:
从C、H、0、N、S这几种元素中,选择合理的元素组成化学式填入空格中.(1)造成煤气中毒的气体:; 2020-04-11 …
(相对原子质量:H—1C—12O—16Ca—40Cl—35.5)某瓶装保健食品的主要功能是补钙,保 2020-05-13 …
如图表示病毒侵入宿主体内的复制过程示意图,请回答:(1)病毒核酸进入宿主细胞后,此时用血清学方法和 2020-05-13 …
(2010•新区二模)从C、H、O、S、Ca、Na六种元素中选择,写出符合下列要求的化学式:(1) 2020-05-14 …
酸类中有一种叫醋酸(CH3COOH ),化学名叫乙酸,它是食醋的主要成分.醋酸在水中只能电离出氢离 2020-05-16 …
醋酸算不算酸酸就是电离的时候产生的阳离子就只有H+,那醋酸呢?也是电离的时候产生的阳离子就只有H+ 2020-06-02 …
肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.H分子中含有1个-CH3, 2020-10-29 …
肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.H分子中含有1个-CH3, 2020-10-29 …
软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成路线为:已知:a.b.H为甲基丙烯 2020-12-25 …
将醋酸稀释,n(H+)、[H+]分别如何变?如题顺便问问,[H+]是氢离子的浓度吗?如果是,那么c( 2021-01-14 …