早教吧作业答案频道 -->化学-->
(1)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染.①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强.则该反应离子方程式为.②电化学降解NO3-的原理
题目详情
(1)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染.
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强.则该反应离子方程式为
___.
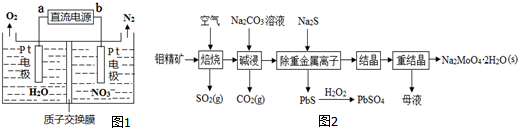
②电化学降解NO3-的原理如图1所示,电源正极为___(填“a”或“b”);阴极反应式为______.
(2)钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图2所示:
1Na2MoO4•2H2O中钼元素的化合价为___;
②焙烧时为了使钼精矿充分反应,可采取的措施是___(答出一条即可);
③焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2
MoO3+SO2(未配平),该反应中氧化产物是___(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为___mol;
④碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___;
⑤过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,
SO42-的去除率为97.5%,已知碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.040mol•L-1,Ksp(BaSO4)=1.0×10-10、则Ksp(BaMoO4)=___[加入Ba(OH)2固体引起的溶液体积变化可忽略].
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强.则该反应离子方程式为
___.
②电化学降解NO3-的原理如图1所示,电源正极为___(填“a”或“b”);阴极反应式为______.
(2)钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图2所示:

1Na2MoO4•2H2O中钼元素的化合价为___;
②焙烧时为了使钼精矿充分反应,可采取的措施是___(答出一条即可);
③焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2
| △ |
| |
④碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___;
⑤过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,
SO42-的去除率为97.5%,已知碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.040mol•L-1,Ksp(BaSO4)=1.0×10-10、则Ksp(BaMoO4)=___[加入Ba(OH)2固体引起的溶液体积变化可忽略].
▼优质解答
答案和解析
(1)①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,说明该反应中生成氢氧根离子,同时还生成水,所以反应方程式为2NO3-+5H2
N2+2OH-+4H2O,
故答案为:2NO3-+5H2
N2+2OH-+4H2O;
②根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,根据电池反应式知,阴极上硝酸根离子得电子生成氮气和水,电极反应式为2NO3-+12H++10e-=N2+6H2O,
故答案为:a;2NO3-+12H++10e-=N2+6H2O.
(2)①计算结晶水合物钼钼酸钠中元素的化合价只计算Na2MoO4中钼元素的化合价即可,钠元素显+1,氧元素显-2,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可知钼酸钠(Na2MoO4•2H2O)中钼元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,
故答案为:+6;
②反应物接触时间越长,反应越充分,焙烧的过程中采用“逆流焙烧”的措施、粉碎矿石或增加空气通入量等,增大钼精矿与空气接触,使其充分反应,提高原料的利用率,
故答案为:将矿石粉碎(或增加空气的进入量或采用逆流原理等);
③焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2
2MoO3+4SO2,元素化合价升高的失去电子发生氧化反应得到氧化产物,反应中Mo元素化合价+2价变化为+6价,硫元素化合价-1价变化为+4价,该反应中氧化产物是MoO3、SO2,反应中生成4mol二氧化硫电子转移28mol,则生成1mol二氧化硫电子转移为7mol,
故答案为:MoO3、SO2;7;
④碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠,离子方程式为MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
⑤当BaMoO4开始沉淀时溶液中钡离子浓度c(Ba2+)=
=
,
溶液中硫酸根离子浓度c(SO42-)=
,
SO42-的去除率为97.5%,1-
=1-
=97.5%,所以Ksp(BaMoO4)=4.0×10-8,
故答案为:4.0×10-8.
| ||
故答案为:2NO3-+5H2
| ||
②根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,根据电池反应式知,阴极上硝酸根离子得电子生成氮气和水,电极反应式为2NO3-+12H++10e-=N2+6H2O,
故答案为:a;2NO3-+12H++10e-=N2+6H2O.
(2)①计算结晶水合物钼钼酸钠中元素的化合价只计算Na2MoO4中钼元素的化合价即可,钠元素显+1,氧元素显-2,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可知钼酸钠(Na2MoO4•2H2O)中钼元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,
故答案为:+6;
②反应物接触时间越长,反应越充分,焙烧的过程中采用“逆流焙烧”的措施、粉碎矿石或增加空气通入量等,增大钼精矿与空气接触,使其充分反应,提高原料的利用率,
故答案为:将矿石粉碎(或增加空气的进入量或采用逆流原理等);
③焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2
| ||
故答案为:MoO3、SO2;7;
④碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠,离子方程式为MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
⑤当BaMoO4开始沉淀时溶液中钡离子浓度c(Ba2+)=
| Ksp(BaMnO 4) |
| c(MnO 4 -) |
| Ksp(BaMoO 4) |
| 0.4mol/L |
溶液中硫酸根离子浓度c(SO42-)=
| Ksp(BaSO 4) |
| c(Ba 2+) |
SO42-的去除率为97.5%,1-
| Ksp(BaSO 4) |
| c(Ba 2+) |
| 1.0×10 -10 | ||
|
故答案为:4.0×10-8.
看了(1)催化硝化法和电化学降解法...的网友还看了以下:
在直线AB上有一点O,过O点的射线OC可以绕O点在AB上侧转动,OD为∠COB的平分线,OE为∠C 2020-04-25 …
臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子 2020-05-12 …
为什么经济全球化不等于政治文化一体化?如何看待西方推行的政治文化一体化? 2020-06-16 …
一个n脚输入的或门是否能被n-1个二脚输入的或门替代,为什么?顺便问个布尔代数化简M.R.P+Q. 2020-06-20 …
空间任意力系向一点的简化空间任意力系向任一点O简化,可得一力和一力偶.这个力的大小和方向等于该力系 2020-07-02 …
关于化学共振结构-resonancestructureordelocalizedstructure 2020-07-09 …
初三下册物理所有能量的转化总结,各举例说明,还有常见的,常考的能量转化都总结一下~O(∩∩)O谢谢 2020-07-24 …
政治文化划分为?根据政治文化的阶级属性,可以把政治文化划分为的政治文化和的政治文化 2020-11-02 …
(2014•从化市一模)如图,已知在Rt△ABC中,∠C=90°,AD是∠BAC的平分线.(1)作一 2020-11-06 …
法治是什么?专业解释起来可能既抽象又吃力。一直以来,浙江省台州市椒江区通过法治文化建设,把“法治”形 2020-11-07 …