早教吧作业答案频道 -->化学-->
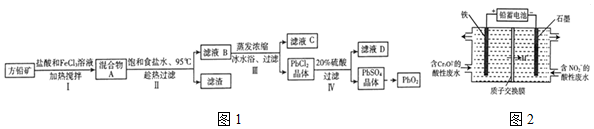
铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如图1:査阅资料:①PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为
题目详情
铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如图1:
査阅资料:①PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为___;
加入盐酸控制pH小于1.0的原因是___.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是___、___.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是___(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有___(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是___
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为___ mol.

査阅资料:①PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g•L-1):
| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
加入盐酸控制pH小于1.0的原因是___.
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是___、___.
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是___(请用平衡移动原理解释).
(4)步骤IV需用溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制,需用到的玻璃仪器有___(填相应的字母).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3,NO2-转化为无毒物质),其装置如图2所示.
①左池中Cr2O72-转化为Cr3+的离子方程式是___
②当阴极区消耗2mol NO2-时,右池减少的H+的物质的量为___ mol.
▼优质解答
答案和解析
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为:PbS+2FeCl3=PbCl2+2FeCl2+S;铁离子易水解诶,加入盐酸控制pH小于1.0可以抑制 Fe3+ 的水解;
故答案为:PbS+2FeCl3=PbCl2+2FeCl2+S;抑制 Fe3+ 的水解;
(2)根据PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0,含有PbCl2的混合物A浸泡溶解时采用95℃和饱和食盐水可以加快浸泡速率增大PbCl2在氯化钠溶液中的溶解度;
故答案为:加快浸泡速率;增大PbCl2在氯化钠溶液中的溶解度;
(3)根据题意:存在PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0,用冰水浴使反应PbCl2(s)+2Cl- (aq)⇌PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
故答案为:冰水浴使反应PbCl2(s)+2Cl- (aq)⇌PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
(4)用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,需要的仪器有量筒、烧杯、玻璃棒;
故答案为:ABE;
(5)①在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②阴极的反应为8H++2NO2-+6e-=N2+H2O,当阴极区消耗2mol NO2-时,转移电子为6mol,减少8molH+,阳极Fe-2e-=Fe2+,得到3molFe2+,6mol正电荷,故有6mol右池减少的6molH+转移到右池,故右池减少的H+的物质的量为2mol;
故答案为:2.
故答案为:PbS+2FeCl3=PbCl2+2FeCl2+S;抑制 Fe3+ 的水解;
(2)根据PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0,含有PbCl2的混合物A浸泡溶解时采用95℃和饱和食盐水可以加快浸泡速率增大PbCl2在氯化钠溶液中的溶解度;
故答案为:加快浸泡速率;增大PbCl2在氯化钠溶液中的溶解度;
(3)根据题意:存在PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0,用冰水浴使反应PbCl2(s)+2Cl- (aq)⇌PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
故答案为:冰水浴使反应PbCl2(s)+2Cl- (aq)⇌PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
(4)用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,需要的仪器有量筒、烧杯、玻璃棒;
故答案为:ABE;
(5)①在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②阴极的反应为8H++2NO2-+6e-=N2+H2O,当阴极区消耗2mol NO2-时,转移电子为6mol,减少8molH+,阳极Fe-2e-=Fe2+,得到3molFe2+,6mol正电荷,故有6mol右池减少的6molH+转移到右池,故右池减少的H+的物质的量为2mol;
故答案为:2.
看了铅蓄电池有广泛的应用,由方铅矿...的网友还看了以下:
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子 2020-04-08 …
如图,线圈L电阻不计,|——L——|——灯泡—|||||——||——|||——开关S——|l——| 2020-04-27 …
宽为L的两光滑竖直裸导轨间接有固定电阻R,导轨(电阻忽略不计)间Ⅰ、Ⅱ区域中垂直纸面向里宽为d、磁 2020-07-06 …
1:7.1g氯气与足量的NaOH反应,转移电子数为0.2NA为什么错了?生成物中NaCl和NaClO 2020-10-31 …
一个半径为R的圆环均匀带电,ab为一段极小的缺口,缺口长L(L远小于R),圆环的带电量为Q(+),在 2020-11-04 …
下列电器中,装有电动机的有,其中应用直流电动机的有。(填序号)A.收音机B.复读机C.电视机D.电冰 2020-11-10 …
锂电池具有高能量、寿命长、可靠性高等优点,即使是在非常低的温度下作业也能有出色的表现.某种锂电池的总 2020-11-24 …
如图所示,电源电压为4.5V,电流表量程为“0~3V”,电流表量程为“0~0.6A”,滑动变阻器R规 2020-12-05 …
质量为M,电量为Q的带电粒子以初速度V进入电场强度为E的匀强电场中,电厂长度为L,电容器极板中点到光 2021-01-02 …
如图所示,电源电压为4.5V,电压表量程为“0-3V”,电流表量程为“0-0.6A”,滑动变阻器规格 2021-01-14 …