早教吧作业答案频道 -->化学-->
某研究小组从一含锌废渣(质量百分组成:40.5%ZnO、19.5%CuO、5.7%FeO、7.3%Fe2O3,其余为SiO2)中回收锌和铜,设计以工业废酸(含15%的H2SO4)为酸浸液的方案,其流程如下图(部分条件略):已
题目详情
某研究小组从一含锌废渣(质量百分组成:40.5%ZnO、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2)中回收锌和铜,设计以工业废酸(含15%的H2SO4)为酸浸液的方案,其流程如下图(部分条件略):已知碱式碳酸锌的化学式为Zn(OH)2•ZnCO3.
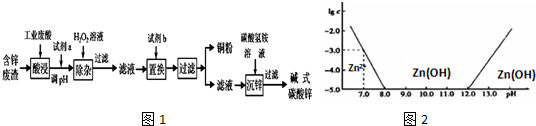
部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
请回答下列问题:
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).
利用图中数据计算,Ksp[Zn(OH)2]=___.
(2)写出试剂a、b的化学式:a:___;b:___.
(3)写出加入H2O2后发生反应的离子反应方程式:___.
(4)写出沉锌过程中的离子反应方程式:___,沉锌后溶液中主要溶质的化学式是___.
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应.写出碱式碳酸锌受热分解的化学方程式___.
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?___ (填“能”或“否”)

部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 | Fe2+ | Fe3+ | Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0mol/L) | 6.5 | 1.5 | 4.2 |
| 沉淀完全时的pH | 9.7 | 3.2 | 6.7 |
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).
利用图中数据计算,Ksp[Zn(OH)2]=___.
(2)写出试剂a、b的化学式:a:___;b:___.
(3)写出加入H2O2后发生反应的离子反应方程式:___.
(4)写出沉锌过程中的离子反应方程式:___,沉锌后溶液中主要溶质的化学式是___.
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应.写出碱式碳酸锌受热分解的化学方程式___.
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?___ (填“能”或“否”)
▼优质解答
答案和解析
生产Zn(NO3)2•6H2O晶体,其工艺流程为:冶炼锌废渣中的锌(40.5%ZnO、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2),加入酸,溶解,加ZnO或Zn(OH)2消耗溶液中的氢离子调节PH,再加入适量H2O2溶液,目的是将未被氧化的Fe2+氧化为Fe3+,然后过滤,后得到滤液含有Zn2+、Cu2+,再加Zn粉把铜离子置换为Cu,过滤,过滤得到硫酸锌溶液,在滤液中加碳酸氢铵,生成碱式碳酸锌,过滤得到碱式碳酸锌;
(1)根据图2可知,当pH=7时,c(Zn2+)=10-3mol/L,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-3×(10-7)2=1×10-17,故答案为:1×10-17;
(2)根据流程分析可知试剂a用于调节溶液的pH,但不能引入杂质,所以a为ZnO或Zn(OH)2,b试剂用于置换铜离子,则b为Zn,故答案为:ZnO或Zn(OH)2;Zn;
(3)H2O2与Fe2+反应生成水和铁离子,其饭的离子方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(4)硫酸锌与碳酸氢铵反应生成碱式碳酸锌和二氧化碳、水、硫酸铵,其反应的离子方程式为:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O;反应后生成产物留在溶液中的主要是硫酸铵;
故答案为:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O;(NH4)2SO4;
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,另外还有二氧化碳和水,其反应方程式为Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O,
故答案为:Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O;
(6)灼烧时ZnCO3不分解,碱式碳酸锌分解Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O,根据物质灼烧前后质量的变化确定生成的二氧化碳和水的质量,然后求出碱式碳酸锌的质量,所以能通过固体质量的减少量来确定固体的成分,故答案为:能.
(1)根据图2可知,当pH=7时,c(Zn2+)=10-3mol/L,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-3×(10-7)2=1×10-17,故答案为:1×10-17;
(2)根据流程分析可知试剂a用于调节溶液的pH,但不能引入杂质,所以a为ZnO或Zn(OH)2,b试剂用于置换铜离子,则b为Zn,故答案为:ZnO或Zn(OH)2;Zn;
(3)H2O2与Fe2+反应生成水和铁离子,其饭的离子方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(4)硫酸锌与碳酸氢铵反应生成碱式碳酸锌和二氧化碳、水、硫酸铵,其反应的离子方程式为:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O;反应后生成产物留在溶液中的主要是硫酸铵;
故答案为:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O;(NH4)2SO4;
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,另外还有二氧化碳和水,其反应方程式为Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O,
故答案为:Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O;
(6)灼烧时ZnCO3不分解,碱式碳酸锌分解Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O,根据物质灼烧前后质量的变化确定生成的二氧化碳和水的质量,然后求出碱式碳酸锌的质量,所以能通过固体质量的减少量来确定固体的成分,故答案为:能.
看了某研究小组从一含锌废渣(质量百...的网友还看了以下:
请问买190克菜,每斤3.5元,总金额多少钱?是不是这样:0.19千克,0.19×7=1.33请问 2020-05-14 …
解中学数学题的高手进来有3题.给10分1.在公式s=Sa+Ut中,当t=3时,s=5.5;当t=5 2020-06-05 …
今年儿子的年龄:28÷7=4(岁),年龄差为24岁再过多少年父子的比是19今年儿子的年龄:28÷7 2020-06-06 …
7分之4÷0.5=21分之19×6分之1+21分之19÷7分之2组词诞()()仿写句子我要开花,是 2020-07-28 …
关于二元一次方程组的算法问题{3x-2y=m+2{2x+y=m-5这组方程是怎么算到x=(3m-8 2020-08-03 …
(1)-11+18-17+16-15可以读作:或(2)(-7)-(+3)+(-2)-(1/8)=73 2020-10-31 …
问一道数学题.速度,在线等待,谢谢了.19.9-19.8+19.7-19.6+19.5-19.4+… 2020-11-15 …
他那题错了尾数为807+7^2+7^3.+7^19+7^20=(7+7^20)*20/2=70*(1 2020-11-17 …
2004年10月19日,中国第一颗业务型同步气象卫星--“风云二号C”发射升空,并进入预定轨道.下列 2020-11-28 …
1.一块牛肉重1500千克,其中蛋白质占20%,脂肪占7%,蛋白质约为脂肪的百分之几?(百分号前保留 2021-01-22 …