早教吧作业答案频道 -->化学-->
辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱
题目详情
辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜.主要工艺流程如下:
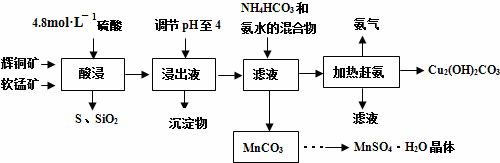
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4•H2O溶于1份冷水、0.6份沸水,不溶于乙醇.
(1)实验室配制250mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要___.
(2)酸浸时,为了提高浸取率可采取的措施有___(任写一点).
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式:___.
(4)调节浸出液pH=4的作用是___.
(5)本工艺中可循环使用的物质是___(写化学式).
(6)获得的MnSO4•H2O晶体需要进一步洗涤、干燥,洗涤时应用___洗涤.
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为___.

已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4•H2O溶于1份冷水、0.6份沸水,不溶于乙醇.
(1)实验室配制250mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要___.
(2)酸浸时,为了提高浸取率可采取的措施有___(任写一点).
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式:___.
(4)调节浸出液pH=4的作用是___.
(5)本工艺中可循环使用的物质是___(写化学式).
(6)获得的MnSO4•H2O晶体需要进一步洗涤、干燥,洗涤时应用___洗涤.
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为___.
▼优质解答
答案和解析
(1)配制一定物质的量浓度的溶液,必不可少的是容量瓶和胶头滴管,容量瓶要标明规格,本题必须使用250mL容量瓶,
故答案为:250mL容量瓶、胶头滴管;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:粉碎矿石或适当升高温度或者搅拌;
(3)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4 ,生成物是CuSO4、MnSO4、S,
把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4,Mn元素化合价变化是:4-2=2,所以二氧化锰化学计量数是2,硫化亚铜的是1,再根据观察法配平其它物质;反应的化学方程式是:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O,
故答案为:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O;
(4)根据金属阳离子生成氢氧化物沉淀的pH范围,使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4,故选择PH=4目的是使Fe3+完全水解生成氢氧化铁沉淀,
故答案为:使Fe3+完全水解生成氢氧化铁沉淀;
(5)工艺流程中,加入了氨水,最后又得到了氨气,NH3 可循环使用,故答案为:NH3 ;
(6)在酒精中,硫酸锰晶体溶解度小,故获得的MnSO4•H2O晶体后常用酒精洗涤;
故答案为:酒精;
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,为硫酸钡物质的量=
=0.02mol,n(MnSO4•H2O)=n(BaSO4)=0.02mol,则此样品中MnSO4•H2O物质的量为:0.02mol×
=0.08mol,则样品中MnSO4•H2O的纯度=
×100%=96.57%;
故答案为:96.57%.
故答案为:250mL容量瓶、胶头滴管;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:粉碎矿石或适当升高温度或者搅拌;
(3)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4 ,生成物是CuSO4、MnSO4、S,
把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4,Mn元素化合价变化是:4-2=2,所以二氧化锰化学计量数是2,硫化亚铜的是1,再根据观察法配平其它物质;反应的化学方程式是:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O,
故答案为:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O;
(4)根据金属阳离子生成氢氧化物沉淀的pH范围,使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4,故选择PH=4目的是使Fe3+完全水解生成氢氧化铁沉淀,
故答案为:使Fe3+完全水解生成氢氧化铁沉淀;
(5)工艺流程中,加入了氨水,最后又得到了氨气,NH3 可循环使用,故答案为:NH3 ;
(6)在酒精中,硫酸锰晶体溶解度小,故获得的MnSO4•H2O晶体后常用酒精洗涤;
故答案为:酒精;
(7)测定MnSO4•H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,为硫酸钡物质的量=
| 4.66g |
| 233g/mol |
| 100 |
| 25 |
| 0.08mol×169g/mol |
| 14.00g |
故答案为:96.57%.
看了 辉铜矿主要成分Cu2S,此外...的网友还看了以下:
我们一般把计算机系统中的资源分为永久性资源和临时性资源,以下( )是临时性资源。A.I/O中断B.内 2020-05-23 …
经济法案例分析某国家机关工作人员甲与其朋友乙、丙、丁四人合伙成立一普通合伙企业.四人商定,甲出资5 2020-06-15 …
执行下面的程序段后,X的值为多少?X=5ForI=1to20Stop2X=X+INextI循环第1次 2020-10-30 …
设A^2=A,则(I+A)^-1=证明:(1)因为A^2=A所以(A+I)A-2(A+I)=-2I所 2020-11-01 …
公司是依法设立的,全部资本由股东出资,以营利为目的的企业法人。这一定义的基本内涵是①公司是企业的一种 2020-11-06 …
(3yv4•漳州模拟)水是人类最宝贵i资源.(v)要除去自然界水中i不溶性固体杂质,可采用i操作方法 2020-11-12 …
2011年10月,中国人民银行和商务部分别发布《外商直接投资人民币结算业务管理办法》和《关于跨境人民 2020-11-21 …
以下哪些属于有限责任公司的法律特征?()A.股东以其认缴的出资额为限承担责任B.股东出资后以下哪些属 2020-12-10 …
二战以来,资本主义国家纷纷制定和实行雇员工资收入的社会保障制度,主要有:最低工资法;利润分享制度,即 2020-12-10 …
关于无形资产以下说法正确的有()以下说法正确的有()A.无形资产是企业发展的核心竞争力B.无形资产的 2020-12-25 …