早教吧作业答案频道 -->化学-->
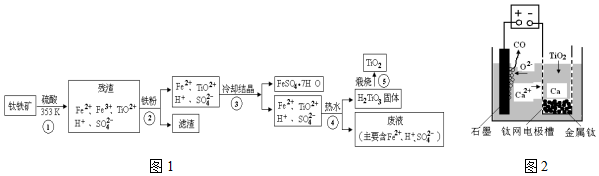
工业上,以钛铁矿为原料制备二氧化钛的工艺流程如图1所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分Fe2+在风化过程中会转化为+3价.已知:TiO(OH)2(即H2TiO3)为两性氢氧化物(
题目详情
工业上,以钛铁矿为原料制备二氧化钛的工艺流程如图1所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分Fe2+在风化过程中会转化为+3价.
已知:TiO(OH)2(即H2TiO3)为两性氢氧化物
(1)步骤②中,发生反应的主要离子方程式为___.
(2)步骤③中,实现混合物的分离是利用物质的___(填字母序号).
A.熔沸点差异 B.溶解性差异 C.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是___(填操作名称).
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:___.
(5)上述工艺流程中可以循环利用的物质是___.
(6)研究发现,可以用石墨作阳极、铁网作阴极、熔触CaF2-CaO作电解质,利用图2所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.
①写出阳极所发生反应的电极反应式___.
②在制备金属Ti前后,CaO的质量将___(填“增大”、“不变”或“减小”)

已知:TiO(OH)2(即H2TiO3)为两性氢氧化物
(1)步骤②中,发生反应的主要离子方程式为___.
(2)步骤③中,实现混合物的分离是利用物质的___(填字母序号).
A.熔沸点差异 B.溶解性差异 C.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是___(填操作名称).
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:___.
(5)上述工艺流程中可以循环利用的物质是___.
(6)研究发现,可以用石墨作阳极、铁网作阴极、熔触CaF2-CaO作电解质,利用图2所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.
①写出阳极所发生反应的电极反应式___.
②在制备金属Ti前后,CaO的质量将___(填“增大”、“不变”或“减小”)
▼优质解答
答案和解析
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe═3Fe2+;
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到;
故答案为:B;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液;
故答案为:过滤;
(4)步骤④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入热水将溶液稀释、升温后,平衡正向移动,生成H2TiO3;
(5)流程中生成了硫酸,步骤①中使用硫酸,可循环使用;
故答案为:H2SO4或硫酸;
(6)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成一氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的一氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+O2--4e-=CO↑;
故答案为:2O2--4e-=O2↑或C+O2--2e-=CO↑;
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑;2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变;
故答案为:不变.
故答案为:2Fe3++Fe═3Fe2+;
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到;
故答案为:B;
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液;
故答案为:过滤;
(4)步骤④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2O⇌H2TiO3+2H+,当加入热水将溶液稀释、升温后,平衡正向移动,生成H2TiO3;
(5)流程中生成了硫酸,步骤①中使用硫酸,可循环使用;
故答案为:H2SO4或硫酸;
(6)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成一氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的一氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+O2--4e-=CO↑;
故答案为:2O2--4e-=O2↑或C+O2--2e-=CO↑;
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑;2Ca+TiO2
| ||
故答案为:不变.
看了工业上,以钛铁矿为原料制备二氧...的网友还看了以下:
下面是李敏同学整理的部分化学知识.其中有错误的是()A.地壳中四种元素含量的比较:O>Al>Si> 2020-04-13 …
三角函数,SOS!如图,在花园小区内有一超市O,已知:文化活动中心A在超市O北偏东30°的方向,物 2020-04-27 …
由氮氧两种元素组成的化合物中,氮氧元素的质量比为7:8,求该化合物的化学式已知C2H2O2和H2O 2020-05-16 …
已知氧化铁在高炉中有下列反应:氧化铁+一氧化碳=2氧化亚铁+二氧化碳,反应形成的固体混合物(氧化铁 2020-05-23 …
录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3+x)的化合物 2020-06-14 …
求助FeO的晶胞结构与氯化钠的晶胞结构相似FeO中存在缺陷会出现一个Fe²+空缺而另两个Fe²+这 2020-07-25 …
作图(1)已知△ABC和点O,画出△DEF,使△DEF和△ABC关于点O成中心对称.(2)已知四边 2020-08-01 …
关于蹦极落至最低点,为什么运动员的速度为零,所受合力不为零?O.O高中的知识我们还没学...唉看网上 2020-11-24 …
录像用的高性能磁带中的磁粉,主要原料之一是由3种元素组成的CoxFe3-xO3+x的化合物,已知O为 2020-12-22 …
录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3+x)的化合物。 2020-12-22 …