早教吧作业答案频道 -->化学-->
铁及其化合物在日常生活中应用广泛,请根据下列实验回答问题.(1)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量
题目详情
铁及其化合物在日常生活中应用广泛,请根据下列实验回答问题.
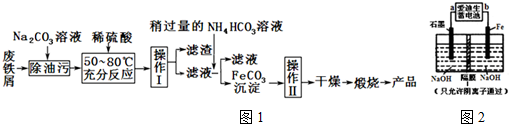
(1)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是___;
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___.
A. Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图1:
回答下列问题:
①操作Ⅰ的名称是___;操作Ⅱ的名称是___;
②请写出生成FeCO3沉淀的离子方程式:___
(4)在一定条件下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g); 工业上有16t Fe2O3在200m3的容器中反应,1小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为___mol/(L•h).
(5)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型饮水消毒剂.用如图2装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是____(填“a”或“b”).
②写出阳极的电极反应式____.
③当制得132.8g高铁酸钠时,阳极区减少的阴离子的物质的量为___.

(1)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是___;
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___.
A. Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图1:
回答下列问题:
①操作Ⅰ的名称是___;操作Ⅱ的名称是___;
②请写出生成FeCO3沉淀的离子方程式:___
(4)在一定条件下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g); 工业上有16t Fe2O3在200m3的容器中反应,1小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为___mol/(L•h).
(5)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O
| 放电 |
| |
| 充电 |
①此装置中爱迪生蓄电池的负极是____(填“a”或“b”).
②写出阳极的电极反应式____.
③当制得132.8g高铁酸钠时,阳极区减少的阴离子的物质的量为___.
▼优质解答
答案和解析
(1)X在足量的空气中高温煅烧,生成有磁性的固体Y,Y为四氧化三铁,与盐酸反应生成氯化铁、氯化亚铁,Y溶于过量盐酸后溶液中大量存在的阳离子是Fe2+、Fe3+、H+,
故答案为:Fe2+、Fe3+、H+;
(2)加入过量的NaOH溶液后,Mg2+、Fe2+、Cu2+转化为沉淀,灼烧后的固体投入过量的稀盐酸,溶液中存在Mg2+、Fe3+、Cu2+,则所得溶液与原溶液相比,溶液中大量减少的阳离子是Fe2+、Al3+,
故答案为:BC;
(3)由制备流程可知,碳酸钠水解显碱性,可促进油污的水解,加稀硫酸除去碳酸钠,且溶解Fe,操作I为过滤,滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,操作II为洗涤,然后干燥、灼烧得到氧化铁.
①由上述分析可知,操作I为过滤,操作II为洗涤,故答案为:过滤;洗涤;
②生成FeCO3沉淀的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O,故答案为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(4)16t Fe2O31小时后测得Fe2O3的转化率为50%,则根据反应方程式可知,反应中消耗CO的物质的量为3×50%×
mol=1.5×105mol,1小时后CO的浓度的变化为
=0.75mol/L,根据v=
可知,CO的消耗速率为
=0.75mol/(L•h),
故答案为:0.75;
(5)①电解制时,铁作阳极,碳棒作阴极,所以爱迪生蓄电池放电时a是负极,b是正极,故答案为:a;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
③132.8g高铁酸钠的物质的量为0.8mol,根据阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O可知,每产生1mol高铁酸根离子,要失去6mol电子,此时从阴极转移6mol氢氧根离子,同时反应中消耗8mol氢氧化根生成1mol高铁酸根离子,所以阳极区共减少1mol阴离子,所以生成0.8mo高铁酸钠l,阳极区减少的阴离子的物质的量为0.8mol,
故答案为:0.8mol.
故答案为:Fe2+、Fe3+、H+;
(2)加入过量的NaOH溶液后,Mg2+、Fe2+、Cu2+转化为沉淀,灼烧后的固体投入过量的稀盐酸,溶液中存在Mg2+、Fe3+、Cu2+,则所得溶液与原溶液相比,溶液中大量减少的阳离子是Fe2+、Al3+,
故答案为:BC;
(3)由制备流程可知,碳酸钠水解显碱性,可促进油污的水解,加稀硫酸除去碳酸钠,且溶解Fe,操作I为过滤,滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,操作II为洗涤,然后干燥、灼烧得到氧化铁.
①由上述分析可知,操作I为过滤,操作II为洗涤,故答案为:过滤;洗涤;
②生成FeCO3沉淀的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O,故答案为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(4)16t Fe2O31小时后测得Fe2O3的转化率为50%,则根据反应方程式可知,反应中消耗CO的物质的量为3×50%×
| 1.6×107 |
| 160 |
| 1.5×10 5mol |
| 2×105L |
| △c |
| △t |
| 0.75mol/L |
| 1h |
故答案为:0.75;
(5)①电解制时,铁作阳极,碳棒作阴极,所以爱迪生蓄电池放电时a是负极,b是正极,故答案为:a;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
③132.8g高铁酸钠的物质的量为0.8mol,根据阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O可知,每产生1mol高铁酸根离子,要失去6mol电子,此时从阴极转移6mol氢氧根离子,同时反应中消耗8mol氢氧化根生成1mol高铁酸根离子,所以阳极区共减少1mol阴离子,所以生成0.8mo高铁酸钠l,阳极区减少的阴离子的物质的量为0.8mol,
故答案为:0.8mol.
看了铁及其化合物在日常生活中应用广...的网友还看了以下:
(2012•泉州)今年五月,惠安一海域发生赤潮导致的鲍鱼大量死亡.产生赤潮的原因是()A.海带紫菜 2020-05-12 …
某植物种子的子叶有黄色和绿色两种,由两对基因控制,现有一个绿色子叶的种子X,种植后与纯合的黄色子叶 2020-05-17 …
判断下列哪些是无穷小量哪些是无穷大量f(x)=(x-2)/x,当x→0时f(x)=lgx,当x→0 2020-06-02 …
大一高数问题无穷小量与无穷大量limf(x)1,下列命题正确的是D(A)无穷小量是个绝对值很小很小 2020-06-06 …
问一个极限问题,lim(x→0)[sin(2/x^2)/x]是不是无穷大量?1/x为无穷大,sin 2020-07-20 …
1.x趋向于0,1/(x^2)*sin(1/x)是a.无穷小量b.无穷大量c.有界量非无穷小量d. 2020-07-31 …
无穷大量能约分吗,比如x~2/x(x-1)x是无穷大量2/x(x-1)能说先同时约去一个x吗?然后得 2020-11-29 …
当x→无穷,e的(-x)次方既不是无穷小量也不是无穷大量当x→∞时e的(-x)次方既不是无穷小量也不 2020-12-10 …
今年云南大旱引发了“桉树致旱”的学术争论。桉树被视为“速生丰产”林种,在华南地区大量种植。(1)桉树 2020-12-23 …
讨论下列函数在x如何变化时是无穷小量?在x如何变化时是无穷大量?f(x)=1/xf(x)=x²-2x 2020-12-23 …