早教吧作业答案频道 -->化学-->
催化剂的活性与选择性是现代化学技术研究的重要内容.I、催化剂改变活化能影响反应速率(1)在汽车尾气排气管口将NO和CO转化成无污染气体.T℃时,分别将等物质的量的NO和CO充入两个
题目详情
催化剂的活性与选择性是现代化学技术研究的重要内容.
I、催化剂改变活化能影响反应速率
(1)在汽车尾气排气管口将NO和CO转化成无污染气体.T℃时,分别将等物质的量的NO和CO充入两个容积均为2L的密闭容器中,保持温度和体积不变,分别历经途径I、Ⅱ反应.反应过程中NO的物质的量随时间变化如图甲所示.
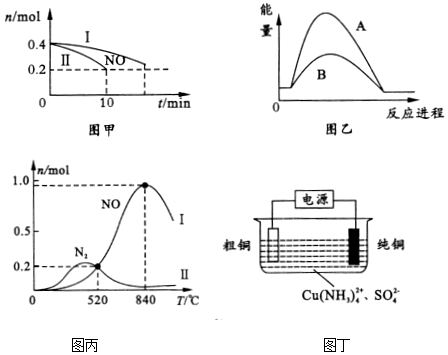
①写出该反应的化学方程式___.
②l0min内途径II的反应速率v(N2)=___;图乙反映了尾气处理的不同途径中反应体系能量变化与反应进程的关系,则途径I对应图乙中的___(填“A”或“B”).汽车尾气排气管口使用催化剂可以提高污染物转化率,其原因是___.
Ⅱ、温度能提高催化剂的选择性
(2)氨催化氧化时会发生两个竞争反应I、Ⅱ.为分析温度对催化剂选择性的影响,在1L密闭容器中充入l mol NH3和2mol O2,测得有关物质的量关系如丙图.
①520℃时,4NH3+3O2⇌2N2+6H2O的平衡常数K的计算表达式为___;
②工业制备HN0O3,选择的最佳温度为___.
Ⅲ、催化剂的制备
(3)金属铜是有机合成催化剂,其纯度影响催化效果.现有铜的提纯利用如图丁装置.则阴极反应的电极反应式为___;在4.825A的电流作用下通电l小时,可以获得纯铜___g(已知F=96500C/mol).
I、催化剂改变活化能影响反应速率
(1)在汽车尾气排气管口将NO和CO转化成无污染气体.T℃时,分别将等物质的量的NO和CO充入两个容积均为2L的密闭容器中,保持温度和体积不变,分别历经途径I、Ⅱ反应.反应过程中NO的物质的量随时间变化如图甲所示.

①写出该反应的化学方程式___.
②l0min内途径II的反应速率v(N2)=___;图乙反映了尾气处理的不同途径中反应体系能量变化与反应进程的关系,则途径I对应图乙中的___(填“A”或“B”).汽车尾气排气管口使用催化剂可以提高污染物转化率,其原因是___.
Ⅱ、温度能提高催化剂的选择性
(2)氨催化氧化时会发生两个竞争反应I、Ⅱ.为分析温度对催化剂选择性的影响,在1L密闭容器中充入l mol NH3和2mol O2,测得有关物质的量关系如丙图.
①520℃时,4NH3+3O2⇌2N2+6H2O的平衡常数K的计算表达式为___;
②工业制备HN0O3,选择的最佳温度为___.
Ⅲ、催化剂的制备
(3)金属铜是有机合成催化剂,其纯度影响催化效果.现有铜的提纯利用如图丁装置.则阴极反应的电极反应式为___;在4.825A的电流作用下通电l小时,可以获得纯铜___g(已知F=96500C/mol).
▼优质解答
答案和解析
(1)①在汽车尾气排气管口将NO和CO转化成无污染气体生成二氧化碳和氮气,反应的化学方程式为2NO+2CO⇌2CO2+N2,
故答案为:2NO+2CO⇌2CO2+N2;
②l0min内途径II中NO物质的量变化为0.4mol-0.2mol=0.2mol,生成氮气物质的量为0.1mol,l0min内途径II的反应速率v(N2)=
=
=0.005mol/(L•min),途径Ⅰ达到平衡时间长,途径Ⅱ达到平衡状态需要时间短,A为活化能大,B为活化能小,途径I对应图乙中A,汽车尾气排气管口使用催化剂可以提高污染物转化率,是因为排气管是敞口容器,管中进行的反应为非平衡状态,该非平衡条件下,反应速率越快相同时间内污染物转化率越高,
故答案为:0.005mol/(L•min);A;排气管是敞口容器,管中进行的反应为非平衡状态,该非平衡条件下,反应速率越快相同时间内污染物转化率越高;
(2)①520℃时反应 4NH3+5O2=4NO+6H2O
变化量(mol/L) 0.2 0.25 0.2 0.3
520℃时,4NH3+3O2⇌2N2+6H2O
起始量(mol/L) 1 2 0 0
变化量(mol/L) 0.4+0.2 0.3+0.25 0.2 0.6
平衡量(mol/L) 0.4 1.45 0.2 0.9
反应的平衡常数K的计算表达式为:K=
,
故答案为:
;
②图象丙分析可知840°C时生成一氧化氮其量最大,工业制备HNO3,选择的最佳温度为840°C,
故答案为:840°C;
(3)粗铜提纯过程中做阳极,精铜做阴极,电解质溶液中Cu(NH3)42+得到电子生成铜,阴极电极反应为:Cu(NH3)42++2e-=Cu+4NH3,在4.825A的电流作用下通电l小时,通过的电量=4.825A×3600s=17370C,通过电子物质的量=
=0.18mol,生成获得纯铜物质的量=0.09mol,质量=0.09mol×64g/mol=5.76g,
故答案为:Cu(NH3)42++2e-=Cu+4NH3;5.76.
故答案为:2NO+2CO⇌2CO2+N2;
②l0min内途径II中NO物质的量变化为0.4mol-0.2mol=0.2mol,生成氮气物质的量为0.1mol,l0min内途径II的反应速率v(N2)=
| △c |
| △t |
| ||
| 10min |
故答案为:0.005mol/(L•min);A;排气管是敞口容器,管中进行的反应为非平衡状态,该非平衡条件下,反应速率越快相同时间内污染物转化率越高;
(2)①520℃时反应 4NH3+5O2=4NO+6H2O
变化量(mol/L) 0.2 0.25 0.2 0.3
520℃时,4NH3+3O2⇌2N2+6H2O
起始量(mol/L) 1 2 0 0
变化量(mol/L) 0.4+0.2 0.3+0.25 0.2 0.6
平衡量(mol/L) 0.4 1.45 0.2 0.9
反应的平衡常数K的计算表达式为:K=
| 0.96×0.24 |
| 0.44×1.453 |
故答案为:
| 0.96×0.24 |
| 0.44×1.453 |
②图象丙分析可知840°C时生成一氧化氮其量最大,工业制备HNO3,选择的最佳温度为840°C,
故答案为:840°C;
(3)粗铜提纯过程中做阳极,精铜做阴极,电解质溶液中Cu(NH3)42+得到电子生成铜,阴极电极反应为:Cu(NH3)42++2e-=Cu+4NH3,在4.825A的电流作用下通电l小时,通过的电量=4.825A×3600s=17370C,通过电子物质的量=
| 17370C |
| 96500C/mol |
故答案为:Cu(NH3)42++2e-=Cu+4NH3;5.76.
看了催化剂的活性与选择性是现代化学...的网友还看了以下:
化学问题求助!(2道)1已知氧化还原反应中存在如下关系:强氧化剂+强还原剂→弱还原剂+弱氧化剂,现 2020-04-26 …
一道预备班数学某农场现有含药5%和9%的两种规格的杀虫剂,现在为了提高杀虫效果,将130升5%的杀 2020-05-14 …
我联想电脑打字时为什么会出现数字?是台式的打O字时会出现78大数字8时会出现O不知道怎么了烦死我了 2020-07-12 …
下列有关说法正确的是()A.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强B.催化剂不影响 2020-11-02 …
下列关于催化剂说法不正确的是()A.加入催化剂可以加快化学反应速率,原因是降低了反应的活化能B.催化 2020-11-03 …
下列说法中正确的是()A.凡是放热反应都是自发的,由于吸热反应都是非自发的B.自发反应在恰当条件下才 2020-11-16 …
有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,反应过程中消除CO的理想 2020-11-20 …
天文学家哈雷曾经在如三82年跟踪过一颗彗星,他算出这颗彗星轨道o半长轴约等于地球公转半径o如8倍,并 2020-11-23 …
酶是生物催化剂,其催化效率受温度、酸碱度和激活剂的影响,已知NaCl是唾液淀粉酶的一种激活剂。请设计 2020-12-27 …
简要回答下列问题1.浓度对化学反应速度有何影响?为什么?2.化学平衡状态有哪些特点?3.为什么催化剂 2021-01-22 …