早教吧作业答案频道 -->化学-->
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁.其生产步骤如图:已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-.请回答:
题目详情
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁.其生产步骤如图:
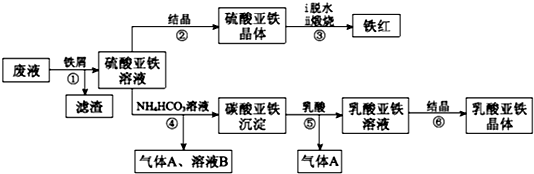
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-.
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是___.
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式___.
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为___.
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因___.
(5)步骤④的离子方程式是___.
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___.
(7)为测定步骤②中所得晶体中FeSO4•7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应).若消耗0.1000mol•L-1 KMnO4溶液20.00mL,所得晶体中FeSO4•7H2O的质量分数为___(用含a的代数式表示).

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-.
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是___.
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式___.
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为___.
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因___.
(5)步骤④的离子方程式是___.
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___.
(7)为测定步骤②中所得晶体中FeSO4•7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应).若消耗0.1000mol•L-1 KMnO4溶液20.00mL,所得晶体中FeSO4•7H2O的质量分数为___(用含a的代数式表示).
▼优质解答
答案和解析
废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2•xH2O,过滤,滤渣为TiO2•xH2O、Fe,滤液为FeSO4,FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;FeSO4溶液中加碳酸氢铵碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体;
(1)分离硫酸亚铁溶液和滤渣的操作是过滤,故答案为:过滤;
(2)TiOSO4水解生成TiO2•xH2O的化学方程式为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4,故答案为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4;
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫的方程式为:4FeSO4+O2
2Fe2O3+4SO3,氧化剂是氧气,还原剂是氧化铁,所以氧化剂和还原剂的物质的量之比为1:4,
故答案为:1:4;
(4)根据碳酸铁的沉淀溶解平衡原理:FeCO3(s)⇌Fe2+(aq)+CO32-(aq),加入乳酸,这样CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,
故答案为:FeCO3(s)⇌Fe2+(aq)+CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
(5)步骤④的离子方程式是Fe2++2HCO3-═FeCO3↓+H2O+CO2↑,故答案为:Fe2++2HCO3-═FeCO3↓+H2O+CO2↑;
(6)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(7)亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据电子守恒,即5FeSO4•7H2O~KMnO4,根据消耗0.1000mol•L-1 KMnO4溶液20.00mL,所以晶体中FeSO4•7H2O的质量分数=
×100%=
,故答案为:
.
(1)分离硫酸亚铁溶液和滤渣的操作是过滤,故答案为:过滤;
(2)TiOSO4水解生成TiO2•xH2O的化学方程式为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4,故答案为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4;
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫的方程式为:4FeSO4+O2
| ||
故答案为:1:4;
(4)根据碳酸铁的沉淀溶解平衡原理:FeCO3(s)⇌Fe2+(aq)+CO32-(aq),加入乳酸,这样CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,
故答案为:FeCO3(s)⇌Fe2+(aq)+CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
(5)步骤④的离子方程式是Fe2++2HCO3-═FeCO3↓+H2O+CO2↑,故答案为:Fe2++2HCO3-═FeCO3↓+H2O+CO2↑;
(6)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(7)亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据电子守恒,即5FeSO4•7H2O~KMnO4,根据消耗0.1000mol•L-1 KMnO4溶液20.00mL,所以晶体中FeSO4•7H2O的质量分数=
| 0.100mol/L×0.02L×5×5×278g/mol |
| a |
| 13.9 |
| a |
| 13.9 |
| a |
看了利用酸解法制钛白粉产生的废液[...的网友还看了以下:
班级计划买一些日记本作为奖品,如果买每本3.5元的日记本,将剩余2.5元;如果买每本4.2元的同样数 2020-03-30 …
有一最沙,第一最沙和第二最沙的比是12:7,第第一最沙运走4分之1,第一最沙就比第二最沙少2.4吨 2020-06-06 …
100的1.8分之一是多少?2.4的3分之一是多少?那100的1.8分之一次方十多少?2.4的3分 2020-06-06 …
班长计划用班费买一些日记本作为文娱活动的奖品,如果买每本3.5元的日记本,将剩余2.5元;如果买每 2020-06-11 …
列式计算.(1)4个2.5相加的和去除3.2与145的差,商是多少?(2)一个数的40%比它的23 2020-07-18 …
被减数减少2.4,减数增加2.4,差减小. 2020-07-22 …
一个四位数的个位是4千位是5十位上的数字比个位上的数字的2倍少2,4个4位上的数字只和是23这4位 2020-07-29 …
某年,下列国家的商品进出口总额比上年的变化情况是:美国减少6.4%德国增长1.3%法国减少2.4%英 2020-11-04 …
数学文字题,帮下忙1.被减数、减数与差的和是85.64,被减数是多少?2.4.7与5.3的和的3倍减 2020-11-27 …
(1)有两吨煤,原来第一吨煤和第二吨煤的比是12:7,从第一吨运走1/4后,这是二吨还比第一吨少2. 2020-11-30 …