早教吧作业答案频道 -->化学-->
现有10%的Na2CO3溶液,请按照下面要求计算:(1)106g上述溶液中所含溶质的质量为g.(2)106g上述溶液与足量10%的稀盐酸反应,最多可生成CO2多少g?(3)向106g上述溶液中逐滴加入10%的稀
题目详情
现有10%的Na2CO3溶液,请按照下面要求计算:
(1)106g上述溶液中所含溶质的质量为___g.
(2)106g上述溶液与足量10%的稀盐酸反应,最多可生成CO2多少g?
(3)向106g上述溶液中逐滴加入10%的稀盐酸并不断搅拌,此时发生反应为:Na2CO3+HCl+NaHCO3+NaCl,当Na2CO3全部转化为NaHCO3后,再加入稀盐酸才开始放出CO2,请在图中画出产生气体的曲线.
(1)106g上述溶液中所含溶质的质量为___g.
(2)106g上述溶液与足量10%的稀盐酸反应,最多可生成CO2多少g?
(3)向106g上述溶液中逐滴加入10%的稀盐酸并不断搅拌,此时发生反应为:Na2CO3+HCl+NaHCO3+NaCl,当Na2CO3全部转化为NaHCO3后,再加入稀盐酸才开始放出CO2,请在图中画出产生气体的曲线.

▼优质解答
答案和解析
(1)106g溶液中所含溶质的质量=106g×10%=10.6g,故填:10.6.
(2)设生成二氧化碳的质量为x,消耗的盐酸溶液中溶质的质量为a,则有
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
10.6g a x
=
=
解得:x=4.4g a=7.3g
(3)设全部转化为碳酸氢钠需要盐酸溶液中溶质的质量为y
Na2CO3+HCl=NaHCO3+NaCl
106 36.5
10.6g y
=
y=3.65g
盐酸溶液的质量为
×100%=36.5g;
碳酸钠完全反应消耗盐酸的质量为:
=73g
故碳酸氢钠完全反应生成二氧化碳消耗盐酸的质量为73g-36.5g=36.5g,故曲线为: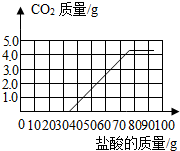
故答为:(1)10.6;(2)最多可生成CO2是4.4g;(3)曲线见上图.
(2)设生成二氧化碳的质量为x,消耗的盐酸溶液中溶质的质量为a,则有
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
10.6g a x
| 106 |
| 10.6g |
| 73 |
| a |
| 44 |
| x |
(3)设全部转化为碳酸氢钠需要盐酸溶液中溶质的质量为y
Na2CO3+HCl=NaHCO3+NaCl
106 36.5
10.6g y
| 106 |
| 36.5 |
| 10.6g |
| y |
盐酸溶液的质量为
| 3.65g |
| 10% |
碳酸钠完全反应消耗盐酸的质量为:
| 7.3g |
| 10% |
故碳酸氢钠完全反应生成二氧化碳消耗盐酸的质量为73g-36.5g=36.5g,故曲线为:

故答为:(1)10.6;(2)最多可生成CO2是4.4g;(3)曲线见上图.
看了现有10%的Na2CO3溶液,...的网友还看了以下:
一种农药,是用药液和水按照1:3000的比例配制而成的.要配制这种农药120.04kg,就需要药液和 2020-03-30 …
一种农药,用药液和水按照1:100配制而成,现在只备有4040千克的药水,要配制这种农药,需要多少千 2020-03-30 …
一种农药,用药液和水按照1:100配制而成,现在只备有4040千克的药水,要配置这种农药,需要多少千 2020-03-31 …
说明是反比例还是正比例,一、一种农药,用药液和水按照1:1500配制而成.(1)540kg水配制农 2020-04-27 …
一种农药,用药液和水按照1:1500配制而成.1.要配制这种农药750.5千克,需要药液和水各多少 2020-05-16 …
农民伯伯在果园里喷农药.这种农药用药液和水按照1:1200配制而成.(1)要配制这种农药600.5 2020-05-22 …
有一种酒精溶液用酒精和水按照1:200配制而成(1)要配置这种酒精溶液1105.5千克,需要酒精和 2020-05-22 …
一种农药,用药液和水按照1:1500配制而成.现有540千克的水,按比例加入药液后可配制出多少千克 2020-06-07 …
一种农药,用药液和水按照1:1500配制而成,要配制这种农药750.5千克,需要药液多少千克;现有 2020-06-18 …
一种稀释液按1:10的比例配制而成,如今有浓缩液20毫升,配制成的稀释液有多少毫升? 2020-07-20 …