早教吧作业答案频道 -->化学-->
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙
题目详情
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C 的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2:1的离子化合物丙.
(1)D的原子结构示意图为___,丙的电子式为___;E在周期表中的位置为___;
(2)下列说法正确的有___;
①化合物乙分子中只含有极性共价键
②C、D、E、F离子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应___;
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式___.
(1)D的原子结构示意图为___,丙的电子式为___;E在周期表中的位置为___;
(2)下列说法正确的有___;
①化合物乙分子中只含有极性共价键
②C、D、E、F离子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应___;
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式___.
▼优质解答
答案和解析
A、B、C、D、E、F为短周期元素,且原子序数依次增大,A是原子半径最小的元素,则A为H元素;B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲,则为B为N元素,甲为NH4NO3;E与B同主族,则E为P元素;C的阳离子与F的阴离子相差一个电子层,结合原子序数可知,C、D均处于第三周期,F原子序数大于P,且可形成阳离子、阴离子个数比为2:1的离子化合物丙,故F为S、C为Na、丙为Na2S;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,则D为Si、乙为SiH4,
(1)D为Si,原子结构示意图为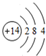 ,丙为Na2S,电子式为
,丙为Na2S,电子式为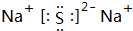 ,E为P元素,在周期表中的位置为:第三周期VA族,
,E为P元素,在周期表中的位置为:第三周期VA族,
故答案为: ;
;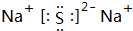 ;第三周期VA族;
;第三周期VA族;
(2))①乙为SiH4,分子只含有极性共价键,故正确;
②钠离子比气体非金属离子少一个电子层,离子半径最小,故错误;
③非金属性B(N)>E(P),故B的氢化物更稳定,故正确;
④甲为NH4NO3,含有离子键、共价键,丙为Na2S,只含有离子键,故错误,
故答案为:①③;
(3)SO2通入BaCl2和HNO3的混合溶液中,HNO3将SO2氧化为SO42-,NO3-本身被还原为NO,SO42-与Ba2+结合生成白色沉淀,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+;
(4)以上元素组成的10电子微粒有NH3、Na+、NH4+,18电子微粒有SiH4、PH3、H2S、HS-、S2-.能相互反应的有2NH3+H2S═2NH4++S2-或NH3+HS-═NH4++S2-或NH3+H2S═NH4++HS-,
故答案为:2NH3+H2S═2NH4++S2-或NH3+HS-═NH4++S2-或NH3+H2S═NH4++HS-.
(1)D为Si,原子结构示意图为
 ,丙为Na2S,电子式为
,丙为Na2S,电子式为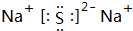 ,E为P元素,在周期表中的位置为:第三周期VA族,
,E为P元素,在周期表中的位置为:第三周期VA族,故答案为:
 ;
;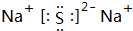 ;第三周期VA族;
;第三周期VA族;(2))①乙为SiH4,分子只含有极性共价键,故正确;
②钠离子比气体非金属离子少一个电子层,离子半径最小,故错误;
③非金属性B(N)>E(P),故B的氢化物更稳定,故正确;
④甲为NH4NO3,含有离子键、共价键,丙为Na2S,只含有离子键,故错误,
故答案为:①③;
(3)SO2通入BaCl2和HNO3的混合溶液中,HNO3将SO2氧化为SO42-,NO3-本身被还原为NO,SO42-与Ba2+结合生成白色沉淀,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+;
(4)以上元素组成的10电子微粒有NH3、Na+、NH4+,18电子微粒有SiH4、PH3、H2S、HS-、S2-.能相互反应的有2NH3+H2S═2NH4++S2-或NH3+HS-═NH4++S2-或NH3+H2S═NH4++HS-,
故答案为:2NH3+H2S═2NH4++S2-或NH3+HS-═NH4++S2-或NH3+H2S═NH4++HS-.
看了A、B、C、D、E、F均为短周...的网友还看了以下:
一道有关于密度的题,大球套小球一个内外由甲、乙两种物质组成的实心球,甲物质的半径是整个球半径的1/ 2020-05-13 …
有几道很难的数学题来问问大家!1、甲乙两地相距6千米,某人从甲地去乙地,前一半时间80米一分钟,后 2020-05-19 …
幼儿园有三个班,甲班比乙班多四人,乙比丙多四人,给小朋友分栗子,甲比乙每人少分三个,乙比?F 2020-07-03 …
1、大圆半径是小圆半径的3倍,大圆面积比小圆面积多75,36平方厘米,大小圆面积各是多少?2、有甲 2020-07-29 …
甲、乙两同学同时从A地赶往B地,甲在前一半路程内用速度v1跑,后一半路程内用速度v2走;乙在前一半时 2020-11-29 …
一道难题,甲乙丙丁四个小朋友共有铅笔38枝,乙比甲的一半多1枝,丙比乙的一半多1枝,丁比丙的一半多1 2020-11-30 …
甲比乙每天多学2个单词,40天后乙学得单词正好是甲的一半,乙中途停止了15天,40天后各学了多少个单 2020-12-04 …
1.甲乙两队进行拔河,甲队用的力为F甲,乙队用的力为F乙.结果乙队胜利,则()AF甲大于F乙BF甲等 2020-12-08 …
1.甲仓存粮150吨,从甲调走20%给乙,甲仓比乙仓的60%还多21吨,乙仓现在有粮食多少吨?2.一 2020-12-14 …
数学,急1、甲乙丙三人存钱,甲比乙多存5分之1,乙比丙多存5分之1,甲存的比丙多几分之几?2、甲乙丙 2020-12-27 …