早教吧作业答案频道 -->化学-->
过氧化钙(CaO2)是一种重要化工试剂,可用于改善水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.过氧化钙是一种白色结晶体粉末,微溶于水,不溶于醇类、乙醚等,加热
题目详情
过氧化钙(CaO2)是一种重要化工试剂,可用于改善水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.过氧化钙是一种白色结晶体粉末,微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易与酸反应生成H2O2.
I、过氧化钙的制取
(1)利用反应Ca+O2
CaO2,在纯氧条件下,制取CaO2.
【查阅资料】金属钙化学性质活泼,能与氧气、氮气、氢气二氧化碳、水、酸等反应.
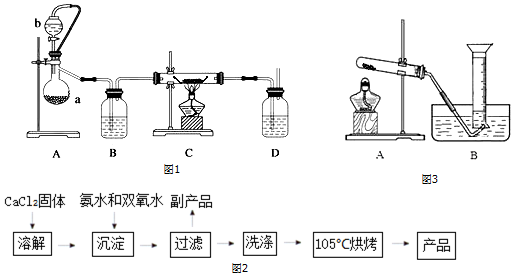
【装置示意图如图1】:请回答下列问题:
①装置A中反应的化学方程式为___;仪器b的名称为___;装置B、D中都盛有浓硫酸,装置B的作用是___(填下面的序号),装置D的作用是___(填下面的序号)
a.观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;
b.除去氧气中水,防止水与金属钙反应;
c.防止空气从后面进入C中;
d.检验氧气
②仪器安装后应进行的实验操作:a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气 e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,正确的操作顺序为___.
③完全反应后,有关数据记录如下:
据此可判断m2与理论值不符,则产物中的杂质可能是___.
(2)在实验室可用钙盐制取CaO2・8H2O,再经脱水制得CaO2.流程示意图如图2,
回答下列问题:①用上述方法制取CaO2・8H2O的化学方程式是___;
②加入氨水的作用是___.
③沉淀反应时常控制温度在0℃左右,其可能原因是___、___,控制温度为0℃左右的方法是___;
④过滤后洗涤沉淀的试剂最好用___ 判断沉淀是否完全洗净的试剂为___;
⑤该制法的副产品为___(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是___.
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
II、过氧化钙含量测定
(3)利用图3装置测量产品中CaO2含量,
①指出图中错误之处___
②收集氧气的最佳时间是___
a.导管口刚有气泡冒出时 b导管口气泡连续均匀冒出时.
③正确读取量筒内液面的初始、最终读数前都需进行的操作是___.
④若样品质量为0.20g,反应前量筒读数为2.10mL,反应后量筒读数为24.50mL(常温下氧气的密度为1.429g/L).实验中量筒的最佳规格是___.(填字母序号)
A.50mL B.100mL C.1L
计算样品中CaO2含量.(要求计算过程)
⑤若样品质量用w表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,则CaO2含量=___(用含m、n、w的式子表示).
此方案测定结果偏小的原因可能是___.
I、过氧化钙的制取
(1)利用反应Ca+O2
| ||
【查阅资料】金属钙化学性质活泼,能与氧气、氮气、氢气二氧化碳、水、酸等反应.
【装置示意图如图1】:请回答下列问题:
①装置A中反应的化学方程式为___;仪器b的名称为___;装置B、D中都盛有浓硫酸,装置B的作用是___(填下面的序号),装置D的作用是___(填下面的序号)
a.观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;
b.除去氧气中水,防止水与金属钙反应;
c.防止空气从后面进入C中;
d.检验氧气
②仪器安装后应进行的实验操作:a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气 e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,正确的操作顺序为___.
③完全反应后,有关数据记录如下:
| 玻璃管质量m0/g | 玻璃管与钙的质量m1/g | 玻璃管与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |
(2)在实验室可用钙盐制取CaO2・8H2O,再经脱水制得CaO2.流程示意图如图2,

回答下列问题:①用上述方法制取CaO2・8H2O的化学方程式是___;
②加入氨水的作用是___.
③沉淀反应时常控制温度在0℃左右,其可能原因是___、___,控制温度为0℃左右的方法是___;
④过滤后洗涤沉淀的试剂最好用___ 判断沉淀是否完全洗净的试剂为___;
⑤该制法的副产品为___(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是___.
A.盐酸 B.氨水 C.稀硫酸 D.氢氧化钠溶液
II、过氧化钙含量测定
(3)利用图3装置测量产品中CaO2含量,
①指出图中错误之处___
②收集氧气的最佳时间是___
a.导管口刚有气泡冒出时 b导管口气泡连续均匀冒出时.
③正确读取量筒内液面的初始、最终读数前都需进行的操作是___.
④若样品质量为0.20g,反应前量筒读数为2.10mL,反应后量筒读数为24.50mL(常温下氧气的密度为1.429g/L).实验中量筒的最佳规格是___.(填字母序号)
A.50mL B.100mL C.1L
计算样品中CaO2含量.(要求计算过程)
⑤若样品质量用w表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,则CaO2含量=___(用含m、n、w的式子表示).
此方案测定结果偏小的原因可能是___.
▼优质解答
答案和解析
I、①装置A是制取氧气的,利用液体和固体反应,所以应该是过氧化氢在二氧化锰的催化下生成水和氧气,对应的化学方程式为 2H2O2
2H2O+O2↑;仪器b的名称为 分液漏斗;由于钙能够和水反应,所以装置B中的硫酸时除去氧气中的水,防止水和钙反应,故选b.而D中都盛有浓硫酸,是防止右侧的空气进入装置C导致钙与空气中的氮气和二氧化碳等反应,故装置D的作用选 c
②仪器安装后应进行的实验操作需要先检查装置的气密性,然后加入药品药品,由于需要排空装置内的空气后才能让氧气和钙反应,所以应该是先通入氧气排空装置内的空气后在点燃酒精灯加热,待反应完全后熄灭酒精灯,此时继续通入氧气知道冷却到室温后停止通知氧气,防止倒入硫酸.故正确的操作顺序为 bcaefgd.
③完全反应后,由有关数据记录,可知,钙的质量为0.28g,理论上生成的过氧化钙的质量为0.5g,则m2应为14.80g+0.5g=15.3g,结果m2与理论值不符,应该是产物中的含有CaO.
(2)
①用上述方法制取CaO2・8H2O,是氯化钙加入了氨水和过氧化氢,生成CaO2・8H2O和氯化铵,对应的化学方程式是 CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O+2NH4Cl;
②加入氨水的作用是做反应物.
③沉淀反应时常控制温度在0℃左右,其可能原因是过氧化氢易分解、CaO2・8H2O易分解,控制温度为0℃左右的方法是使用冰水混合物;
④由于信息提示“过氧化钙不溶于醇类、乙醚等“,所以过滤后洗涤沉淀的试剂最好用乙醇.判断沉淀是否完全洗净实际上就是看固体表面是否附着氯化铵,也就是检验洗涤后的液体中是否有氯离子,所以所用的试剂为硝酸银溶液;
⑤该制法的副产品为 NH4Cl(填化学式),为了提高副产品的产率,也就是提高氨水的吸收效率,且不能引入新的杂质,所以应该是使用盐酸.故选 A.
II、过氧化钙含量测定
(3)
①指出图中错误之处 量筒内没有装满水
②由于生成气体就是氧气,所以应该是从开始就收集,这一点和氧气的制取里面的收集时区别的,收集氧气强调的是收集氧气的纯净,而本实验强调的收集氧气的多少.所以本实验收集氧气的最佳时间是 a(导管口刚有气泡冒出时).
③正确读取量筒内液面的初始、最终读数前都需进行的操作要保证内外压强相等,避免大气压强的对体积测定的影响,所以要采取的操作是调整内外液面在一个平面.
④若样品质量为0.20g,反应前量筒读数为2.10mL(即0.0021L),反应后量筒读数为24.50mL(即0.0245L)(常温下氧气的密度为1.429g/L).由于体积小于50mL,所以为减少误差,实验中量筒的最佳规格是50mL的量筒.
氧气的质量为1.429g/L×(0.0245L-0.0021L)≈0.032g
设CaO2质量为x
CaO2
Ca+O2↑
72 32
x 0.032g
=
x=0.072g
样品中CaO2质量分数为
×100%=36%.
⑤若样品质量用wg表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,根据差量就是生成的氧气的质量可知.生成氧气的质量为mg-ng.
设设CaO2质量为y
CaO2
Ca+O2↑
72 32
y mg-ng
=
y=
g
样品中CaO2质量分数为
×100%=
×100%.
此方案测定结果偏小的原因可能是 钙与氧气重新结合.
故答案为:
(1)
①2H2O2
I、①装置A是制取氧气的,利用液体和固体反应,所以应该是过氧化氢在二氧化锰的催化下生成水和氧气,对应的化学方程式为 2H2O2
| ||
②仪器安装后应进行的实验操作需要先检查装置的气密性,然后加入药品药品,由于需要排空装置内的空气后才能让氧气和钙反应,所以应该是先通入氧气排空装置内的空气后在点燃酒精灯加热,待反应完全后熄灭酒精灯,此时继续通入氧气知道冷却到室温后停止通知氧气,防止倒入硫酸.故正确的操作顺序为 bcaefgd.
③完全反应后,由有关数据记录,可知,钙的质量为0.28g,理论上生成的过氧化钙的质量为0.5g,则m2应为14.80g+0.5g=15.3g,结果m2与理论值不符,应该是产物中的含有CaO.
(2)
①用上述方法制取CaO2・8H2O,是氯化钙加入了氨水和过氧化氢,生成CaO2・8H2O和氯化铵,对应的化学方程式是 CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O+2NH4Cl;
②加入氨水的作用是做反应物.
③沉淀反应时常控制温度在0℃左右,其可能原因是过氧化氢易分解、CaO2・8H2O易分解,控制温度为0℃左右的方法是使用冰水混合物;
④由于信息提示“过氧化钙不溶于醇类、乙醚等“,所以过滤后洗涤沉淀的试剂最好用乙醇.判断沉淀是否完全洗净实际上就是看固体表面是否附着氯化铵,也就是检验洗涤后的液体中是否有氯离子,所以所用的试剂为硝酸银溶液;
⑤该制法的副产品为 NH4Cl(填化学式),为了提高副产品的产率,也就是提高氨水的吸收效率,且不能引入新的杂质,所以应该是使用盐酸.故选 A.
II、过氧化钙含量测定
(3)
①指出图中错误之处 量筒内没有装满水
②由于生成气体就是氧气,所以应该是从开始就收集,这一点和氧气的制取里面的收集时区别的,收集氧气强调的是收集氧气的纯净,而本实验强调的收集氧气的多少.所以本实验收集氧气的最佳时间是 a(导管口刚有气泡冒出时).
③正确读取量筒内液面的初始、最终读数前都需进行的操作要保证内外压强相等,避免大气压强的对体积测定的影响,所以要采取的操作是调整内外液面在一个平面.
④若样品质量为0.20g,反应前量筒读数为2.10mL(即0.0021L),反应后量筒读数为24.50mL(即0.0245L)(常温下氧气的密度为1.429g/L).由于体积小于50mL,所以为减少误差,实验中量筒的最佳规格是50mL的量筒.
氧气的质量为1.429g/L×(0.0245L-0.0021L)≈0.032g
设CaO2质量为x
CaO2
| ||
72 32
x 0.032g
| 72 |
| 32 |
| x |
| 0.032g |
x=0.072g
样品中CaO2质量分数为
| 0.072g |
| 0.20g |
⑤若样品质量用wg表示,反应前称量药品和试管总质量为m g,反应后在空气中冷却,称量药品和试管总质量为n g,根据差量就是生成的氧气的质量可知.生成氧气的质量为mg-ng.
设设CaO2质量为y
CaO2
| ||
72 32
y mg-ng
| 72 |
| 32 |
| y |
| mg-ng |
y=
| 9(m-n) |
| 4 |
样品中CaO2质量分数为
| ||
| wg |
| 9×(m-n) |
| 4w |
此方案测定结果偏小的原因可能是 钙与氧气重新结合.
故答案为:
(1)
①2H2O2
看了过氧化钙(CaO2)是一种重要...的网友还看了以下:
环保部门对某工厂的废水进行分析,结果表明:废水中含少量硫酸.取一定量废水用2%的氢氧化钠溶液中和( 2020-05-13 …
下列有关说法不正确的是()A.为防止水污染,可用O3替代Cl2作饮用水消毒剂B.实验室可用浓硫酸干 2020-05-14 …
某工厂的废水含有硫酸,取一定量的废水用2%的氢氧化钠溶液中和假设废水出硫酸外其他成分不与氢氧化钠反 2020-05-16 …
重铬酸钾法做COD怎么稀释水样?例稀释5倍是取4毫升废水用蒸馏水稀释到20毫升,还是取10毫升废水 2020-05-17 …
循环水废水池废水通过废水泵提升至( )。 2020-05-28 …
用PAM和PAC处理过的污水能否用活性炭吸附悬浮物研磨废水用PAC和PAM处理过的水任然不是很清澈 2020-07-02 …
某化工厂排出的废水透明、澄清、略显蓝色.一同学取少量废水,用盐酸酸化,有白色沉淀生成(不溶于稀硝酸 2020-07-02 …
用氢氧化钙处理100t含硫酸9.8%的工业废水.用氢氧化钙处理100t含硫酸9.8%的工业废水,处 2020-07-23 …
食品废水(含蛋白质高)加入一些菌种进行曝气致使COD增加,而这些食品废水用于作物施肥,是否会污染环境 2020-11-05 …
下列关于水的说法错误的是()A.蒸馏法是海水淡化的方法之一B.长期饮用纯净水,可能会引起一些微量元素 2020-12-12 …
 扫描下载二维码
扫描下载二维码
