早教吧作业答案频道 -->化学-->
NO2是形成雾霾天气的原因之一.(1)重型车辆常在排气管内喷淋尿素[CO(NH2)2]溶液,使NO2转化为无污染物质.采用“喷淋”的目的是,反应的活化能(选填“增大”“减小”“不变”
题目详情
NO2是形成雾霾天气的原因之一.
(1)重型车辆常在排气管内喷淋尿素[CO(NH2)2]溶液,使NO2转化为无污染物质.采用“喷淋”的目的是___,反应的活化能___(选填“增大”“减小”“不变”),配平该反应的化学方程式:___.【已知:CO(NH2)2中N呈-3价】
___NO2+___CO(NH2)2═___N2+___CO2+___H2O
(2)以CO2与NH3为原料可合成化肥尿素.已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-l59.5KJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(l)△H=-160.5KJ•mol-1
③H2O(l)═H2O(g)△H=+44.0KJ•mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式___.
(3)恒温下将1.6molNH3和0.8molCO2放入容积为8L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是___.
a.容器内气体压强保持不变 b.CO2与NH3的速率之比为1:2
c.NH2CO2NH4(s)质量保持不变 d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05mol•L-1.则平衡时CO2的转化率α=___;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率___(选填“增大”“减小”“不变”).
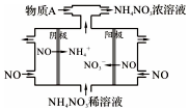
(4)为减少NO2排放,可将NO2转化为NO后通入如图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是___.

(1)重型车辆常在排气管内喷淋尿素[CO(NH2)2]溶液,使NO2转化为无污染物质.采用“喷淋”的目的是___,反应的活化能___(选填“增大”“减小”“不变”),配平该反应的化学方程式:___.【已知:CO(NH2)2中N呈-3价】
___NO2+___CO(NH2)2═___N2+___CO2+___H2O
(2)以CO2与NH3为原料可合成化肥尿素.已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-l59.5KJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(l)△H=-160.5KJ•mol-1
③H2O(l)═H2O(g)△H=+44.0KJ•mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式___.
(3)恒温下将1.6molNH3和0.8molCO2放入容积为8L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是___.
a.容器内气体压强保持不变 b.CO2与NH3的速率之比为1:2
c.NH2CO2NH4(s)质量保持不变 d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05mol•L-1.则平衡时CO2的转化率α=___;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率___(选填“增大”“减小”“不变”).
(4)为减少NO2排放,可将NO2转化为NO后通入如图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是___.
▼优质解答
答案和解析
(1)尿素以喷淋的形式进入排气管,可增大与NO2气体的接触面积,加快了反应速率,但不改变反应的活化能;NO2中氮元素为+4价,转化为N2中0价,化合价降低4价,CO(NH2)2中氮元素-3价,转化为N2中0价,化合价降得6价,故最小公倍数为24,故NO2前系数为产6,CO(NH2)2前系数为产4,再结合原子守恒配平生成物;
故答案为:增大接触面积,加快反应速率;不变;6; 4;7; 4; 8;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l)△H=-160.5kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0 KJ/mol;
(3)a.反应前后气体反应物和生成物的系数和不等,正反应是体积减小的方向,在恒温恒容条件下,压强不变是平衡状态,故a正确;b.伴随反应的进行,CO2与NH3的速率之比始终为1:2,无法判断是平衡状态,故b错误;c.NH2CO2NH4(s)质量保持不变可说明是平衡状态,故c正确;d.反应在恒温条件下进行,无法判断是平衡状态,故d错误;
2NH3+CO2⇌NH2CO2NH4,
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.1 0.05 0
平衡量(mol/L) 0.1 0.05 0
CO2的转化率=
×100%=
=50%
改变NH2CO2NH4(s)质量平衡不移动,CO2的转化率不变;
故答案为:ac;50%;不变;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总电极反应方程式为:8NO+7H2
3NH4NO3+2HNO3可知补充的A为NH3,使NO全部转化为NH4NO3总化学反应方程式是8NO+2NH3+7H2O=5NH4NO3;
故答案为:8NO+2NH3+7H2O=5NH4NO3.
故答案为:增大接触面积,加快反应速率;不变;6; 4;7; 4; 8;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l)△H=-160.5kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0 KJ/mol;
(3)a.反应前后气体反应物和生成物的系数和不等,正反应是体积减小的方向,在恒温恒容条件下,压强不变是平衡状态,故a正确;b.伴随反应的进行,CO2与NH3的速率之比始终为1:2,无法判断是平衡状态,故b错误;c.NH2CO2NH4(s)质量保持不变可说明是平衡状态,故c正确;d.反应在恒温条件下进行,无法判断是平衡状态,故d错误;
2NH3+CO2⇌NH2CO2NH4,
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.1 0.05 0
平衡量(mol/L) 0.1 0.05 0
CO2的转化率=
| 消耗量 |
| 起始量 |
| 0.05mpl/l |
| 0.1mol/l |
改变NH2CO2NH4(s)质量平衡不移动,CO2的转化率不变;
故答案为:ac;50%;不变;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总电极反应方程式为:8NO+7H2
| ||
故答案为:8NO+2NH3+7H2O=5NH4NO3.
看了NO2是形成雾霾天气的原因之一...的网友还看了以下:
A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是 2020-04-08 …
A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是 2020-04-08 …
(2012•宁德二模)Ⅰ配合物Na2[Fe(CN)5(NO)]可用于离子检验.(1)配合物中同周期 2020-05-13 …
配合物Na2[Fe(CN)5(NO)]可用于离子检验.(1)配合物中同周期元素的第一电离能由小到大 2020-05-13 …
元素原子序数计算的技巧求解为什么主族和0族当原子序数小于80时用个位加十位+1可得较小同族的元素原 2020-05-22 …
XYZ是周期表中的前20号元素,其原子序数依次增大.X是原子半径最小的元素,Y元素的最高正价与最低 2020-06-03 …
下列说法中错误的个数有几个)分数不是化为有限小数就是化为无限循环小数(2)分毌是偶敉的分数一定能化 2020-06-27 …
氯元素的单质及其化合物在生产生活中都很重要.回答下列问题:(1)与氯元素同族的短周期元素的原子结构 2020-07-10 …
A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和 2020-07-22 …
下表是元素周期表的一部分.族周期IIAIVAVIIA1①2②③④⑤⑥⑦⑧⑨⑩(11)(1)表中所列 2020-07-29 …