早教吧作业答案频道 -->化学-->
甲醇又称“木精”,是非常重要的化工原料.(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学
题目详情
甲醇又称“木精”,是非常重要的化工原料.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式___.
(2)甲醇脱氢可制取甲醛CH3OH(g)
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图1所示.
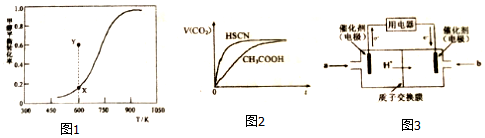
①该脱氢反应的△H___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是___
③下列叙述不能说明该脱氢反应已经达到平衡状态的是___.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___,反应结束后所得两溶液中,C(CH3COO-)___ c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为___.
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式___.
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |
| 脱氢 |
| |

①该脱氢反应的△H___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是___
③下列叙述不能说明该脱氢反应已经达到平衡状态的是___.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___,反应结束后所得两溶液中,C(CH3COO-)___ c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为___.
▼优质解答
答案和解析
(1)CO(g)+2H2(g)=CH3OH(g),反应热=反应物总键能-生成物总键能,故△H=1076kJ•mol-1+2×436kJ•mol-1-(3×413+351+463)kJ•mol-1=-105kJ•mol-1,故热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1;
(2)①升高温度,甲醇的平衡转化率升高,故向正反应方向进行,故正反应方向为吸热反应,△H>0,
故答案为:>;
②600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆);原因是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆),
故答案为:<;600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆);
③A.c(CH3OH)=c(HCHO),不能说明反应达到平衡状态,故A选;
B.HCHO的体积分数保持不变,即HCHO的浓度保持不变,能说明反应达到平衡状态,故B不选;
C.V正(CH3OH)=V逆(HCHO),正逆反应速率相等,能说明反应达到平衡状态,故C不选;
D.根据质量守恒定律,及反应前后气体体积不变,故混合气体平均分子量保持不变,不能说明反应达到平衡状态,故D选,
故答案为:AD;
(3)①由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
②通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=
=
=
×10-7L/mol;
故答案为:
×10-7L/mol;
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应,即甲醇被氧化为二氧化碳,结合碳元素的化合价变化确定失电子数目,根据原子守恒和电荷守恒配平,电极反应式为CH3OH-6e-+H2O=CO2+6H+.
故答案为:CH3OH-6e-+H2O=CO2+6H+.
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1;
(2)①升高温度,甲醇的平衡转化率升高,故向正反应方向进行,故正反应方向为吸热反应,△H>0,
故答案为:>;
②600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆);原因是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆),
故答案为:<;600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆);
③A.c(CH3OH)=c(HCHO),不能说明反应达到平衡状态,故A选;
B.HCHO的体积分数保持不变,即HCHO的浓度保持不变,能说明反应达到平衡状态,故B不选;
C.V正(CH3OH)=V逆(HCHO),正逆反应速率相等,能说明反应达到平衡状态,故C不选;
D.根据质量守恒定律,及反应前后气体体积不变,故混合气体平均分子量保持不变,不能说明反应达到平衡状态,故D选,
故答案为:AD;
(3)①由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
②通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=
| c(CH3COO-)×c(H+) |
| c(CH3COOH) |
| b×10-7 | ||
|
| 2b |
| a-2b |
故答案为:
| 2b |
| a-2b |
(4)根据题给装置知本题考查酸性甲醇燃料电池,根据外电路电子流向判断左侧电极为电池的负极,发生氧化反应,即甲醇被氧化为二氧化碳,结合碳元素的化合价变化确定失电子数目,根据原子守恒和电荷守恒配平,电极反应式为CH3OH-6e-+H2O=CO2+6H+.
故答案为:CH3OH-6e-+H2O=CO2+6H+.
看了甲醇又称“木精”,是非常重要的...的网友还看了以下:
化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)的能量.以下是部分共价键键能的 2020-04-07 …
开机找不到键盘鼠标或开机时提示按“F1”继续,或者是在桌面上鼠标乱跑,解决的办法是更换键盘或鼠标。 2020-05-31 …
转K6型转向架基础制动装置装用( )型制动梁。A.L-A或L-BB.L-C或2TNC.转K3或槽钢弓 2020-06-07 …
硼氢化钾水解放出的氢气能与-N=C-键形成-NH-CH-键吗?或者直接和硼氢化钾反应?求解决办法, 2020-07-03 …
直线方程一般的解题思路1.已知直线L的,关与一个点A对称.或者关于一条直线L2对称,求对称与L的把 2020-07-13 …
以下关于量子数l描述错误的的是()A.被称作角量子数或副量子数B.l取值受到n的限制C.l不可以取 2020-07-15 …
化学反应可视为旧键断裂和新键形成的过程.共价键的键能是两种原子间形成1mol共价键(或其逆过程)时 2020-07-19 …
高中化学。。有机物结构简式中,官能团的单键可以省吗?比如醛基CH之间的单键、醚键C与O和其他元素的单 2020-11-26 …
帮忙找几个古诗的赏析要那种很详细的,比如一个关键字或者关键句子的赏析1:次北固山下王湾的2:赤壁杜牧 2020-12-07 …
(2003•陕西)计算2003的算术平方根时,现有如下三个方案,请你只选择其中一个方案填空:方案一: 2021-01-22 …