早教吧作业答案频道 -->化学-->
已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出:CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原
题目详情
已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出:CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下
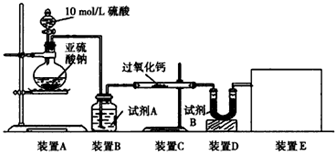
(1)试剂A可以选用___,试剂B的作用是___.
(2)装置E用于测定氧气的体积,请在方框中画出装置图.
(3)实验测得装置C中过氧化钙质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V-m1关系式.
未被氧化:___,部分被氧化:___,完全被氧化:___.
若SO2完全被氧化,写出反应的化学方程式:___.
实验二:向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点.
(4)提出假设:
假设1:反应后固体中只有___,证明SO2未被氧化;
假设2:反应后固体中只有___,证明SO2完全被氧化;
假设3:___.
实验探究:(5)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:___.
实验评价:(6)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:___.
实验一:通过测量气体的体积判断发生的化学反应,实验装置如下

(1)试剂A可以选用___,试剂B的作用是___.
(2)装置E用于测定氧气的体积,请在方框中画出装置图.
(3)实验测得装置C中过氧化钙质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V-m1关系式.
未被氧化:___,部分被氧化:___,完全被氧化:___.
若SO2完全被氧化,写出反应的化学方程式:___.
实验二:向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点.
(4)提出假设:
假设1:反应后固体中只有___,证明SO2未被氧化;
假设2:反应后固体中只有___,证明SO2完全被氧化;
假设3:___.
实验探究:(5)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:___.
实验评价:(6)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:___.
▼优质解答
答案和解析
实验一:(1)过氧化钙和水反应,装置B中试剂能吸收水蒸气,所以试剂为浓硫酸,干燥气体除去水蒸气,
故答案为:浓硫酸;吸收水蒸气干燥气体;
(2)测定氧气的体积利用排水量气法:装置为以下几种装置中的一种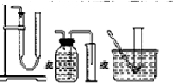 ,
,
故答案为: ;
;
(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则发生反应:2CaO2+2SO2=2CaSO3+O2
依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 反应增重
1mol 96g
m1g
V=
L
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4;反应过程中 无氧气生成,V=0,若0<V<
,则二氧化硫部分被氧化;
故答案为:
;0<V<
;0;CaO2+SO2=CaSO4;
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究
(4)假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3:固体为Na2SO3和Na2SO4的混合物;
故答案为:Na2SO3;Na2SO4;固体为Na2SO3和Na2SO4的混合物;
(5)证明假设3是正确的,实验设计为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
故答案为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫;
(6)实验过程中SO2的通入量直接影响探究实验结果的科学性,若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
故答案为:若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的.
故答案为:浓硫酸;吸收水蒸气干燥气体;
(2)测定氧气的体积利用排水量气法:装置为以下几种装置中的一种
 ,
,故答案为:
 ;
;(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则发生反应:2CaO2+2SO2=2CaSO3+O2
依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 反应增重
1mol 96g
| VL |
| 22.4L/mol |
V=
| 7m1 |
| 30 |
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4;反应过程中 无氧气生成,V=0,若0<V<
| 7m1 |
| 30 |
故答案为:
| 7m1 |
| 30 |
| 7m1 |
| 30 |
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究
(4)假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3:固体为Na2SO3和Na2SO4的混合物;
故答案为:Na2SO3;Na2SO4;固体为Na2SO3和Na2SO4的混合物;
(5)证明假设3是正确的,实验设计为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
故答案为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫;
(6)实验过程中SO2的通入量直接影响探究实验结果的科学性,若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
故答案为:若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的.
看了已知:过氧化钙与CO2反应有气...的网友还看了以下:
碳燃烧时,由于条件不同,可能生成一氧化碳,也可能生成二氧化碳.下列对一氧化碳和二氧化碳比较合理的说 2020-05-13 …
关于氧化还原反应.处理它们的关系有点乱.什么是氧化性和还原性.什么事氧化剂和还原剂.什么是氧化物关 2020-05-17 …
关于化学原电池电解池电解方面的问题每当遇到这种题目时我就迷,记住的那些东西也都没有掌握原理,不会用 2020-05-23 …
化学反应类型间的关系梳理(具体的)我对化学反应类型特别乱,我知道无机物四种基本反应类型,包括氧化还 2020-05-23 …
氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康.一旦泄露需要及时处理,一般 2020-06-30 …
(2012•上海模拟)氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是 2020-07-13 …
为什么山地的周围是盆地,盆地的周围是山地?山地和盆地有什么内在的转化关系吗?是什么原理造成的?(地 2020-07-25 …
MoO3是金属氧化物也是碱性氧化物,对么?原题如下2005年诺贝尔化学奖获得者施罗克等人发现金属钼的 2020-11-01 …
火力发电厂释放出大量的氮氧化物(NOx)、二氧化碳、二氧化硫等气体会造成环境污染.但二氧化硫、二氧化 2020-11-30 …
Mg+N2==点燃==Mg3N2中还原剂是什么?请详细说明理由Mg的化合价在此升高了,而N2的化合价 2021-01-23 …