早教吧作业答案频道 -->化学-->
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是(2)氧硫化碳(COS)的电
题目详情
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是___
(2)氧硫化碳(COS)的电子式为:___.
(3)下列事实正确且能说明碳与硫两元素非金属性相对强弱的有___
A.同条件同浓度溶液pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
D.分解温度:CH4>H2S
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS
H2S
Na2S溶液
M溶液+H2
①已知:常温下,反应Ⅱ中每吸收1.7gH2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为___
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为___
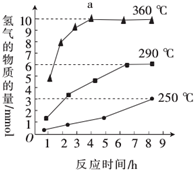
③如图是反应Ш中,在不同反应温度下,反应时间与H2产量的关系(Na2 S初始含量为3 mmol).由图象分析可知,a点时M溶液中除S2O32-外,还有___(填含硫微粒的 离子符号).

(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是___
(2)氧硫化碳(COS)的电子式为:___.
(3)下列事实正确且能说明碳与硫两元素非金属性相对强弱的有___
A.同条件同浓度溶液pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
D.分解温度:CH4>H2S
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS
| H2O |
| |
| Ⅰ |
| NaOH溶液 |
| |
| Ⅱ |
| △ |
| |
| Ⅲ |
①已知:常温下,反应Ⅱ中每吸收1.7gH2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为___
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为___
③如图是反应Ш中,在不同反应温度下,反应时间与H2产量的关系(Na2 S初始含量为3 mmol).由图象分析可知,a点时M溶液中除S2O32-外,还有___(填含硫微粒的 离子符号).
▼优质解答
答案和解析
(1)组成氧硫化碳和磷化氢的原子为O、S、P、H,氢元素有1个电子层,氧元素有2个电子层,磷、硫有3个电子层,所以磷、硫的原子半径大于氢、氧的原子半径,磷、硫是同周期元素,硫的原子序数大于磷的原子序数,由元素周期律知,磷的原子半径大于硫的原子半径,磷最外层为5个电子,处于第三周期第VA族,
故答案为:第三周期第VA族;
(2)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为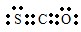 ,
,
故答案为: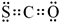 ;
;
(3)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度以及最高正价氧化物对应水化物酸性强弱等角度,而最高正化合价、氢化物的沸点高低不能用于比较元素的非金属性强弱,
A.同条件同浓度溶液pH:Na2CO3>Na2SO4,说明碳酸酸性小于硫酸,最高价氧化物对应水化物形成的酸的酸性越强对应非金属性越强,故A正确;
B.酸性:H2SO3>H2CO3 ,亚硫酸不是最高价氧化物,不能判断非金属性强弱,故B错误;
C.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故C正确;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强,分解温度:CH4>H2S,氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D错误;
故答案为:AC;
(4)①反应Ⅱ为硫化氢和氢氧化钠的反应H2S+2NaOH=Na2S+H2O,1.7g H2S的物质的量为n=
=
=0.5mol,反应放出热量4.76kJ,则1mol硫化氢反应放出95.2KJ的热量,所以该反应的热化学方程式为H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol,
故答案为:H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O
S2O32-+4H2↑+2OH-,
故答案为:2S2-+5H2O
S2O32-+4H2↑+2OH-;
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O
S2O32-+4H2↑+2OH-,生成氢气:3mmol×
=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,反应为:S2-+4H2O
SO42-+4H2↑,
故答案为:SO42-.
故答案为:第三周期第VA族;
(2)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为
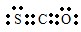 ,
,故答案为:
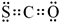 ;
;(3)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度以及最高正价氧化物对应水化物酸性强弱等角度,而最高正化合价、氢化物的沸点高低不能用于比较元素的非金属性强弱,
A.同条件同浓度溶液pH:Na2CO3>Na2SO4,说明碳酸酸性小于硫酸,最高价氧化物对应水化物形成的酸的酸性越强对应非金属性越强,故A正确;
B.酸性:H2SO3>H2CO3 ,亚硫酸不是最高价氧化物,不能判断非金属性强弱,故B错误;
C.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故C正确;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强,分解温度:CH4>H2S,氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D错误;
故答案为:AC;
(4)①反应Ⅱ为硫化氢和氢氧化钠的反应H2S+2NaOH=Na2S+H2O,1.7g H2S的物质的量为n=
| m |
| M |
| 17g |
| 34g/mol |
故答案为:H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O
| ||
故答案为:2S2-+5H2O
| ||
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O
| ||
| 4 |
| 2 |
| ||
故答案为:SO42-.
看了氧硫化碳(COS)可替代磷化氢...的网友还看了以下:
二氧化碳与一氧化碳化学性质上的主要区别是()A.二氧化碳无毒,一氧化碳有毒B.一氧化碳难溶于水,二 2020-05-13 …
推测结构A,B,C是分子式为C5H10的烯烃的三种同分异构体,催化氢化都生成2-甲基丁烷,A和B酸 2020-06-17 …
实验驯化硝化反硝化菌疑问:硝化菌属于自养需氧,反硝化缺氧异养.本课题属于同步硝化反硝化.1.可不可 2020-06-21 …
甲乙丙丁是初中化学常见的化合物,甲和乙中含有碳元素,丙能做干燥剂.它们之间有如图所示的转化关系(部 2020-06-26 …
催化氧化也属于燃烧吗?平时指的燃烧是什么?如果某物质既能燃烧又能发生催化氧化反应,那我将该物质引燃 2020-07-05 …
氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化 2020-07-06 …
化简后被开方数与根号7的被开方数相同的是()A.根号77B.根号70C.根号0.7D.根化简后被开 2020-08-02 …
固定化细胞对酶的活性影响最小,根本原因是()A.避免了细胞破碎、酶的提取纯化过程B.固定化细胞在多种 2020-11-02 …
下列说法你认为错误的是()A.化学变化和化学性质是同一个概念B.物质发生化学变化时一定发生物理变化C 2020-12-10 …
被征收人选择房屋产权调换的,政府提供等面积房屋用于产权调换,并与被征收人计算、结清被征收房屋价值与用 2020-12-10 …