早教吧作业答案频道 -->化学-->
低浓度SO2废气的处理是工业难题,工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如图.(1)为了使SO2尽可能吸收完全,在不改变吸
题目详情
低浓度SO2废气的处理是工业难题,工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如图.
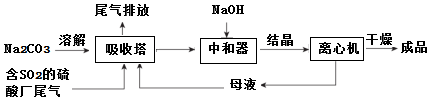
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合理措施___、___.(写出两条)
(2)中和器中发生的主要反应的离子方程式是___.
(3)图1为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.
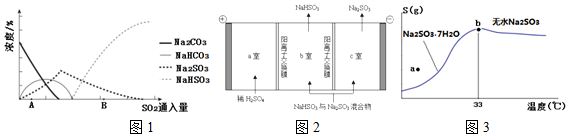
①则初期反应(图中A点以前)的化学方程式是___.
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如图2:简述分离NaHSO3与Na2SO3混合物的原理___.
(4)图3是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是___
A.a点时溶液为不饱和溶液
B.b点时Na2SO3•7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是___
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4.

(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合理措施___、___.(写出两条)
(2)中和器中发生的主要反应的离子方程式是___.
(3)图1为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.

①则初期反应(图中A点以前)的化学方程式是___.
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如图2:简述分离NaHSO3与Na2SO3混合物的原理___.
(4)图3是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是___
A.a点时溶液为不饱和溶液
B.b点时Na2SO3•7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是___
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4.
▼优质解答
答案和解析
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合理措施有:控制SO2流速、增大Na2CO3溶液的浓度、适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等;
故答案为:控制SO2流速、增大Na2CO3溶液的浓度(适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等);
(2)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠,发生的离子方程式为:HSO3-+OH-=SO32-+H2O;
故答案为:HSO3-+OH-=SO32-+H2O;
(3)①由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠,反应反应方程式为:2Na2CO3+SO2+H2O=2 NaHCO3+Na2SO3;
故答案为:2Na2CO3+SO2+H2O=2 NaHCO3+Na2SO3;
②通过电解法可分离NaHSO3与Na2SO3混合物,阳极2H2O-4e-=4H++O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3.阴极2H+-2e-=H2↑,导致HSO3-⇌H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3,实现Na2SO3的循环利用;
故答案为:阳极4OH--4e-=2H2O+O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3;阴极2H+-2e-=H2↑,导致HSO3- H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3;
(4)A.处于曲线上的点为饱和溶液状态,A点在曲线上方,应为过饱和溶液,故A错误;
B.B点为生成晶体的转折点,两种晶体可以共存,故B正确;
C.由于冷却至33℃以下时析出Na2SO3•7H2O,应在维持95~100℃蒸发浓缩至有大量晶体析出,再利用余热蒸干,故C错误;
故答案为:B;
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,
A.Na2SO3 吸收二氧化硫发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,1molNa2SO3 最多吸收二氧化硫1mol;
B.Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;
C.Ba(NO3)2 吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;
D.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;
吸收量最多的是Ba(NO3)2;
故答案为:C.
故答案为:控制SO2流速、增大Na2CO3溶液的浓度(适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等);
(2)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠,发生的离子方程式为:HSO3-+OH-=SO32-+H2O;
故答案为:HSO3-+OH-=SO32-+H2O;
(3)①由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠,反应反应方程式为:2Na2CO3+SO2+H2O=2 NaHCO3+Na2SO3;
故答案为:2Na2CO3+SO2+H2O=2 NaHCO3+Na2SO3;
②通过电解法可分离NaHSO3与Na2SO3混合物,阳极2H2O-4e-=4H++O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3.阴极2H+-2e-=H2↑,导致HSO3-⇌H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3,实现Na2SO3的循环利用;
故答案为:阳极4OH--4e-=2H2O+O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3;阴极2H+-2e-=H2↑,导致HSO3- H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3;
(4)A.处于曲线上的点为饱和溶液状态,A点在曲线上方,应为过饱和溶液,故A错误;
B.B点为生成晶体的转折点,两种晶体可以共存,故B正确;
C.由于冷却至33℃以下时析出Na2SO3•7H2O,应在维持95~100℃蒸发浓缩至有大量晶体析出,再利用余热蒸干,故C错误;
故答案为:B;
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,
A.Na2SO3 吸收二氧化硫发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,1molNa2SO3 最多吸收二氧化硫1mol;
B.Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;
C.Ba(NO3)2 吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;
D.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;
吸收量最多的是Ba(NO3)2;
故答案为:C.
看了 低浓度SO2废气的处理是工业...的网友还看了以下:
用扇子一扇,燃着的蜡烛立即熄灭,其原因是A.空气流通使蜡烛接触的氧气减少B.空气流动带走燃烧的热量 2020-05-13 …
蜡烛的火焰可以用嘴吹灭的主要原因是()A.吹气时,气流使蜡烛的温度降低到着火点以下B.吹气时,气流 2020-05-13 …
英语翻译1.大气空气气压低,空气不流动时主要因素.由于空气的不流动,使空气中的微小颗粒聚集,漂浮在 2020-05-22 …
来自海洋的湿润气流使我国东部地区什么丰沛. 2020-06-28 …
我国位于亚欧大陆东部西岸,来自海洋的温湿气流使我国东部充沛,资源较丰富. 2020-06-28 …
某一套管换热器,管间用饱和水蒸气加热管内空气,使空气温度从17.某一套管换热器,管间用饱和水蒸气加 2020-06-30 …
取某钢样粉末3.00g,放在氧气流中充分灼烧,并使反应的气流通过足量含140Ba(OH)2溶液,得 2020-07-03 …
取某钢样粉末3.00g,放在氧气流中充分灼烧,并使反应后的气流通过足量的Ba(OH)2溶液,得到0 2020-07-03 …
(2013•徐州)如图所示,对着瓶口吹气能发出声音.吹气时,瓶口外空气流速变大,压强变,促使瓶内气体 2020-11-11 …
(2009•常德)2007年10月24日18时05分,“嫦娥一号”探月卫星从西昌卫星发射中心用“长征 2020-11-12 …