早教吧作业答案频道 -->化学-->
兴趣小组的同学为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图象(如图所示),请回答问题:(1)由pH变化图
题目详情
兴趣小组的同学为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图象(如图所示),请回答问题:
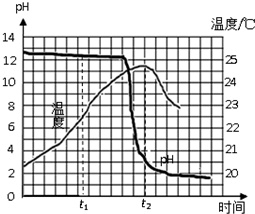
(1)由pH变化图象可知,在t1时刻,烧杯中存在的阴离子是___(填写离子符号).
(2)由温度变化图象可知,稀盐酸和氢氧化钠溶液发生的化学反应是___(选填“放热”或“吸热”)反应.
(3)根据酸和碱反应的特点,可将氢氧化铝制成抗胃酸(主要成分为HCl)药剂,它与另一种抗胃酸药剂碳酸氢钠相比,在建议每次服用剂量下(见表),其药效“强”而且“持久”,其可能原因是:___.(提示:NaHCO3+HCl=NaCl+H2O+CO2↑)

(1)由pH变化图象可知,在t1时刻,烧杯中存在的阴离子是___(填写离子符号).
(2)由温度变化图象可知,稀盐酸和氢氧化钠溶液发生的化学反应是___(选填“放热”或“吸热”)反应.
(3)根据酸和碱反应的特点,可将氢氧化铝制成抗胃酸(主要成分为HCl)药剂,它与另一种抗胃酸药剂碳酸氢钠相比,在建议每次服用剂量下(见表),其药效“强”而且“持久”,其可能原因是:___.(提示:NaHCO3+HCl=NaCl+H2O+CO2↑)
| 主要成分 (均占药片质量的95%) | 主要成分的 相对分子质量 | 建议每次 服用剂量/g |
| Al(OH)3 | 78 | 0.25 |
| NaHCO3 | 84 | 0.5 |
▼优质解答
答案和解析
(1)由pH变化图象可知,在t1时刻,溶液显碱性,溶液中阴离子有氢氧根离子和氯离子;
(2)由温度变化图象可知,稀盐酸和氢氧化钠溶液发生的反应放出热量;
(3)设0.5g碳酸氢钠消耗盐酸的质量为x,则有
NaHCO3+HCl═NaCl+H2O+CO2↑
84 36.5
0.5g x
=
x=0.22g
设0.25g氢氧化铝消耗盐酸的质量为y,则有
Al(OH)3+3HCl═AlCl3+3H2O
78 109.5
0.25g y
=
y=0.35g
通过计算可以看出,0.35gAl(OH)3比0.5gNaHCO3能中和更多的HCl,所以药效强于NaHCO3,
故答案为:(1)Cl-和OH-(2)放热
(3)0.35g含Al(OH)3的抗胃酸药剂比0.5g含NaHCO3的抗胃酸药剂能中和更多的HCl,所以药效强于NaHCO3;Al(OH)3和HCl反应速率慢于NaHCO3和HCl,所以药效比服用NaHCO3持久
(2)由温度变化图象可知,稀盐酸和氢氧化钠溶液发生的反应放出热量;
(3)设0.5g碳酸氢钠消耗盐酸的质量为x,则有
NaHCO3+HCl═NaCl+H2O+CO2↑
84 36.5
0.5g x
| 84 |
| 0.5g |
| 36.5 |
| x |
x=0.22g
设0.25g氢氧化铝消耗盐酸的质量为y,则有
Al(OH)3+3HCl═AlCl3+3H2O
78 109.5
0.25g y
| 78 |
| 0.25g |
| 109.5 |
| y |
y=0.35g
通过计算可以看出,0.35gAl(OH)3比0.5gNaHCO3能中和更多的HCl,所以药效强于NaHCO3,
故答案为:(1)Cl-和OH-(2)放热
(3)0.35g含Al(OH)3的抗胃酸药剂比0.5g含NaHCO3的抗胃酸药剂能中和更多的HCl,所以药效强于NaHCO3;Al(OH)3和HCl反应速率慢于NaHCO3和HCl,所以药效比服用NaHCO3持久
看了兴趣小组的同学为研究酸和碱反应...的网友还看了以下:
英语翻译基因组学是对生物遗传信息的结构、组成、传递、表达与调控以及功能的系统研究.目前对于小麦基因 2020-04-09 …
如何提高初中语文教学效率的研究内容 2020-05-17 …
动物生理调控大概的研究内容是什么? 2020-05-23 …
软件工程学包括软件开发技术和软件工程管理两部分,下面()是与工程管理中有关的研究内容。A.开发方 2020-05-23 …
软件工程学包含软件开发技术和软件工程管理两部分,下列选项()是与工程管理中有关的研究内容。A.开 2020-05-24 …
软件工程方法学的研究内容,包含软件开发技术和软件工程管理两个部分,其期望达到的最终目标是()。A 2020-05-24 …
软件工程方法学的研究内容,包含软件开发技术和软件工程管理两大部分,其期望达到的最终目标是()。A 2020-05-24 …
简述图书馆学的研究内容与体系结构? 2020-05-31 …
文字学的研究内容包括书写符号体系的发生、发展历史。 2020-05-31 …
在藏书建设的研究内容中,什么是搞好藏书建设的基础? 2020-05-31 …