早教吧作业答案频道 -->化学-->
氯气用途广泛,但在使用时,一般会产生氯化氢.工业上可用O2将HCl转化为Cl2,以提高效益,减少污染.反应为:O2+4HCl催化剂250~400℃2Cl2+2H2O
题目详情
氯气用途广泛,但在使用时,一般会产生氯化氢.工业上可用O2将HCl转化为Cl2,以提高效益,减少污染.反应为:O2+4HCl
2Cl2+2H2O
完成下列填空:
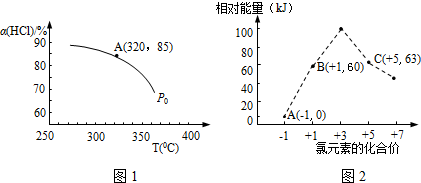
(1)该反应化学平衡常数K的表达式为___;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图1所示,则正反应是___反应(填“吸热”或者“放热”).
(2)上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由:___.
(3)该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10-3mol,则此时容器中的n(HCl)=___mol.
(4)对该反应达到平衡后,以下分析正确的是___(选填编号).
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5)氯元素能形成多种离子.在水溶液中1molCl-、1mol ClOx-(x=1,2,3,4)能量的相对大小如图2所示,写出B→A+C反应的热化学方程式(用离子符号表示)___;若有1.5molB发生反应,转移电子___mol.
| 催化剂 |
| |
| 250~400℃ |

完成下列填空:
(1)该反应化学平衡常数K的表达式为___;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图1所示,则正反应是___反应(填“吸热”或者“放热”).
(2)上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由:___.
(3)该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10-3mol,则此时容器中的n(HCl)=___mol.
(4)对该反应达到平衡后,以下分析正确的是___(选填编号).
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5)氯元素能形成多种离子.在水溶液中1molCl-、1mol ClOx-(x=1,2,3,4)能量的相对大小如图2所示,写出B→A+C反应的热化学方程式(用离子符号表示)___;若有1.5molB发生反应,转移电子___mol.
▼优质解答
答案和解析
(1)O2+4HCl
2Cl2+2H2O的平衡常数k=
;升高温度平衡向吸热的方向移动,根据图知,温度升高,氯化氢的转化下降,即平衡逆向移动,所以该反应的正反应为放热反应,
故答案为:
;放热;
(2)正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大,故压缩体积使压强增大,画相应αHCl~T曲线的示意图为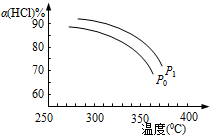 ,
,
故答案为: ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大;
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大;
(3)设反应中氯化氢的起始的物质的量为amol,反应在P0、320°C条件下进行,达平衡状态A时,氯化氢的转化率为85%,即有85%amol的氯化氢反应生成氯气的物质的量为
×85%amol=7.2×10-3mol,所以a=1.69×10-2,所以平衡时容器中的n(HCl)=15%amol=2.54×10-3mol,
故答案为:2.54×10-3;
(4)a.增加n(HCl),平衡正向移动,即对正反应的反应速率影响更大,故a正确;
b.体积不变加入稀有气体,各物质的浓度不变,所以平衡不移动,正逆反应速率 不变,故b错误;
c.压强不变加入稀有气体,则体积变大,相当于对原平衡体系减压,则平衡向逆反应方向移动,所以正反应的反应速率下降得更多,故c错误;
d.如果平衡常数K值增大,即平衡向正反应方向移动,即正反应速率大于逆反应的速率,由于该反应为放热反应,所以要降低温度,所以逆反应速率下降得要比正反应速率多,故d正确;
故选ad;
(5)B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,根据方程式可知,每当有3mol的ClO-反应,可转移电子4mol,所以若有1.5molClO-发生反应,转移电子为2mol
故答案为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;2.
| 催化剂 |
| 250~400℃ |
| c 2(Cl 2)×c 2(H 2O) |
| c 4(HCl)×c(O 2) |
故答案为:
| c 2(Cl 2)×c 2(H 2O) |
| c 4(HCl)×c(O 2) |
(2)正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,相同温度下HCl的平衡转化率比之前实验的大,故压缩体积使压强增大,画相应αHCl~T曲线的示意图为
 ,
,故答案为:
 ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大;
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大;(3)设反应中氯化氢的起始的物质的量为amol,反应在P0、320°C条件下进行,达平衡状态A时,氯化氢的转化率为85%,即有85%amol的氯化氢反应生成氯气的物质的量为
| 1 |
| 2 |
故答案为:2.54×10-3;
(4)a.增加n(HCl),平衡正向移动,即对正反应的反应速率影响更大,故a正确;
b.体积不变加入稀有气体,各物质的浓度不变,所以平衡不移动,正逆反应速率 不变,故b错误;
c.压强不变加入稀有气体,则体积变大,相当于对原平衡体系减压,则平衡向逆反应方向移动,所以正反应的反应速率下降得更多,故c错误;
d.如果平衡常数K值增大,即平衡向正反应方向移动,即正反应速率大于逆反应的速率,由于该反应为放热反应,所以要降低温度,所以逆反应速率下降得要比正反应速率多,故d正确;
故选ad;
(5)B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以该热化学反应方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol,根据方程式可知,每当有3mol的ClO-反应,可转移电子4mol,所以若有1.5molClO-发生反应,转移电子为2mol
故答案为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol;2.
看了氯气用途广泛,但在使用时,一般...的网友还看了以下:
“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程.如:两分子烯烃R 2020-04-11 …
将不饱和烃在催化剂作用下用臭氧(O3)氧化,则生成有羰基的化合物:现把一定量的以组成为C4H8表示 2020-04-11 …
实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)或加热高锰酸钾的方法制取氧气.(1)写出用上述 2020-05-14 …
一个化学方程式写出葡萄糖在催化剂的作用上生成二氧化碳和乙醇的化学方程式? 2020-06-13 …
谁能帮我解释一下催是什么意思就是把一个人当催用你就一他的一个催.这催嘛死意思啊 2020-07-07 …
就是把一个人当催用你就一他的一个催.这催嘛死意思啊 2020-07-07 …
过氧化氢(H2O2)溶液在二氧化锰作催化剂的条件下能迅速分解产生水和氧气(如图所示).分液漏斗可以 2020-07-08 …
实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)或加热高锰酸钾的方法制取氧气.(1)写出用上述 2020-07-20 …
已知使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3)],可使炔烃的氢化停留在生成烯烃的阶段, 2020-11-02 …
如图是医用过氧化氢溶液说明书的部分内容,请阅读并回答问题.(1)在医疗的外用上,采用含过氧化氢3%左 2020-11-20 …