早教吧作业答案频道 -->化学-->
钼酸钠晶体(Na2MoO4•2H2O)是公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS)制备钼酸钠晶体的部分流程如图1:(1)写出“碱浸”反应的离子方程式;(2)减浸
题目详情
钼酸钠晶体(Na2MoO4•2H2O)是公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS)制备钼酸钠晶体的部分流程如图1:
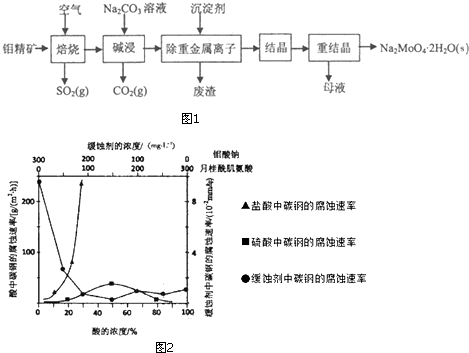
(1)写出“碱浸”反应的离子方程式___;
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42-.当BaMoO4开始沉淀时,SO42-的去除率是___;[已知:碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.04mol•L-1,Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是___;
(4)如图2是碳钢在3种不同介质中的腐蚀速率实验结果:
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___;
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2.NaNO2的作用是___;
③若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为___.

(1)写出“碱浸”反应的离子方程式___;
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42-.当BaMoO4开始沉淀时,SO42-的去除率是___;[已知:碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.04mol•L-1,Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是___;
(4)如图2是碳钢在3种不同介质中的腐蚀速率实验结果:
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___;
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2.NaNO2的作用是___;
③若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为___.
▼优质解答
答案和解析
(1)三氧化钼与碳酸钠反应生成了MoO42-,反应的离子方程式为:MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(2)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=
=1×10-7mol/L,
溶液中硫酸根离子的浓度为:c(SO42-)=
mol/L=1.1×10-3mol/L,
硫酸根离子的去除率为:1-
×100%=1-2.75%≈97.3%,
故答案为:97.3%;
(3)由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理,
故答案为:使用一定次数后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(4)①由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;
②NaNO2的具有氧化性,能够在钢铁表面形成FeMoO4-Fe2O3保护膜,
故答案为:替代空气中氧气起氧化剂作用;
③根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mg•L-1,
1L溶液中含有的钼酸钠物质的量为:
≈7.28×10-4mol,
所以钼酸钠溶液的物质的量浓度为:7.28×l0-4mol•L-1,
故答案为:7.28×l0-4mol•L-1.
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(2)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=
| 4.0×10-8 |
| 0.40mol/L |
溶液中硫酸根离子的浓度为:c(SO42-)=
| 1.1×10-10 |
| 1×10-7 |
硫酸根离子的去除率为:1-
| 1.1×10-3 |
| 0.04 |
故答案为:97.3%;
(3)由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理,
故答案为:使用一定次数后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(4)①由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢;
②NaNO2的具有氧化性,能够在钢铁表面形成FeMoO4-Fe2O3保护膜,
故答案为:替代空气中氧气起氧化剂作用;
③根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mg•L-1,
1L溶液中含有的钼酸钠物质的量为:
| 150×10-3g |
| 206g/mol |
所以钼酸钠溶液的物质的量浓度为:7.28×l0-4mol•L-1,
故答案为:7.28×l0-4mol•L-1.
看了钼酸钠晶体(Na2MoO4•2...的网友还看了以下:
某校化学兴趣小组参观碱式碳酸镁的生产后,知道了以水氯镁石(主要成分为MgCl2·6H2O)为原料生 2020-04-11 …
下图为某地区某种物流线路示意图。读图,回答18~20题:小题1:该物流的主要运输方式最有可能是() 2020-05-01 …
写出函数解析式,1题,油箱中有油30升,若油从油管中均匀流出,150分钟流完,则油箱中剩余油量Q( 2020-05-20 …
蜘蛛8条腿蜻蜓6条腿,2对翅膀蝉6条腿,1对翅膀如果三种动物公18只,共有腿118条,翅膀20对. 2020-06-07 …
以水氯镁石(主要成分为MgCl2•6H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)z•w 2020-06-09 …
刚果河河口没有形成明显的三角洲的原因?1.主要流经低平的盆地,利于河水流动中泥沙沉积2.流域内热带 2020-07-20 …
某校化学兴趣小组参观碱式碳酸镁的生产后,知道了以水氯镁石(主要成分为MgCl2·6H2O)为原料生 2020-07-20 …
关于黄河含沙量大的原因,说法错误的是:()1.主要流经沙漠地区2.流域多暴雨3.黄土高原土质疏松4 2020-07-22 …
想知道流速公式并且把我的数据计算出来要补充现在说有点急流量2.1m3/h压力1.0进出口径1寸流量7 2020-11-26 …
直流与交流电的回路问题1、直流输电是否必须形成回路(现实中都有回路,无论哪种运行方式),为什么直流输 2020-12-05 …