早教吧作业答案频道 -->化学-->
工业利用NaOH溶液或氨水喷淋捕捉空气中的CO2制造甲醇,流程图如图1所示:(1)下列有关捕捉空气中的CO2过程中的叙述不正确的有.A、X选用CaO,而且要循环利用CaO与Y溶液B、捕捉室里温度
题目详情
工业利用NaOH溶液或氨水喷淋捕捉空气中的CO2制造甲醇,流程图如图1所示:
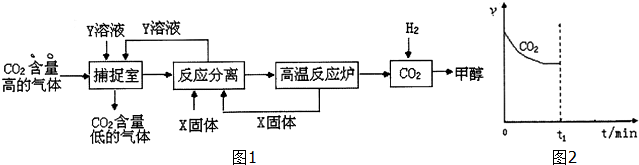
(1)下列有关捕捉空气中的CO2过程中的叙述不正确的有___.
A、X选用CaO,而且要循环利用CaO与Y溶液
B、捕捉室里温度越高越有利于CO2 的捕捉
C、开放高效光催化剂分解水制氢气,是降低合成甲醇成本的有效途径
D、该捕捉CO2技术的应用有利于缓解全球变暖,而且能耗小
(2)在捕捉室用稀氨水喷淋“捕捉”空气中的CO2时,有NH2COONH4(氨基甲酸胺)生成.现将一定量纯净的氨基甲酸胺置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应
NH2COONH4(s)⇌2NH3(g)+CO2(g)达到分解平衡.实验测得不同温度及反应时间(t1<t2<t3)的有关表:氨基甲酸铵分解时温度、气体总浓度及反应时间的关系
①氨基甲酸胺分解反应为___反应(选填“吸热”、“放热”).在25℃,0-t1时间内产生氨气的平均速率为:___.
②根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)⇌NH2COONH4(s)平衡常数K约为___.
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H<0.
①将1mol CO2和3mol H2充入恒温恒压的密闭容器中发生上述反应,CO2消耗速率v(CO2)与时间关系如图2所示.若在时间t1时,向容器中再充入1mol CO2和3mol H2,请在图中画出CH3OH生成速率v(CH3OH)与时间的关系曲线.
②在一个恒温固定容积的密闭容器中,加入1mol CO2和3mol H2,充分反应后达到平衡放出热量为aKJ.若在原来的容器中加入2mol CO2和6mol H2,在相同温度下充分反应,达到平衡放出热量为bKJ.则a和b满足的关系___.

(1)下列有关捕捉空气中的CO2过程中的叙述不正确的有___.
A、X选用CaO,而且要循环利用CaO与Y溶液
B、捕捉室里温度越高越有利于CO2 的捕捉
C、开放高效光催化剂分解水制氢气,是降低合成甲醇成本的有效途径
D、该捕捉CO2技术的应用有利于缓解全球变暖,而且能耗小
(2)在捕捉室用稀氨水喷淋“捕捉”空气中的CO2时,有NH2COONH4(氨基甲酸胺)生成.现将一定量纯净的氨基甲酸胺置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应
NH2COONH4(s)⇌2NH3(g)+CO2(g)达到分解平衡.实验测得不同温度及反应时间(t1<t2<t3)的有关表:氨基甲酸铵分解时温度、气体总浓度及反应时间的关系
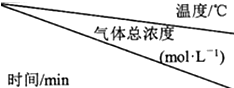 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
②根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)⇌NH2COONH4(s)平衡常数K约为___.
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H<0.
①将1mol CO2和3mol H2充入恒温恒压的密闭容器中发生上述反应,CO2消耗速率v(CO2)与时间关系如图2所示.若在时间t1时,向容器中再充入1mol CO2和3mol H2,请在图中画出CH3OH生成速率v(CH3OH)与时间的关系曲线.
②在一个恒温固定容积的密闭容器中,加入1mol CO2和3mol H2,充分反应后达到平衡放出热量为aKJ.若在原来的容器中加入2mol CO2和6mol H2,在相同温度下充分反应,达到平衡放出热量为bKJ.则a和b满足的关系___.
▼优质解答
答案和解析
(1)A.NaOH溶液或氨水喷淋捕捉空气中的CO2会得到碳酸氢钠、碳酸氢铵溶液,加入CaO,会得到碳酸钙,氢氧化钠或氨气,氢氧化钠与氨气可以循环利用,碳酸钙分解得到CuO与二氧化碳,CaO循环利用,故A正确;
B.温度过高,碳酸氢钠、碳酸氢铵容易分解,不利于二氧化碳的捕捉,故B错误;
C.开放高效光催化剂分解水制氢气,可以降低能耗,故C正确;
D.捕捉到的CO2可制备其它化工产品,减少了温室气体排放,但碳酸钙分解能耗大,制备氢气能耗大,故D错误.
故选:BD;
(2)①不同温度条件下,t2、t3时刻混合气体总浓度不变,说明t2时刻均到达平衡,而升高温度平衡时混合气体总浓度增大,说明升高温度平衡正向移动,则正反应为吸热反应,
由方程式可知混合气体中氨气与二氧化碳的浓度之比为2:1,在25℃,0-t1时间内产生氨气浓度为2.7×10-3mol/L×
=1.8×10-3mol/L,则氨气的平均速率为:
=
×10-3mol/(L.min),
故答案为:吸热;
×10-3mol/(L.min);
②氨气与二氧化碳的浓度之比为2:1,15℃平衡时氨气浓度为2.4×10-3mol/L×
=1.6×10-3mol/L,二氧化碳的浓度为2.4×10-3mol/L-1.6×10-3mol/L=8×10-4mol/L,则平衡常数K=
=
=4.9×108,
故答案为:4.9×108;
(3)①向容器中再充入1mol CO2和3mol H2,平衡正向移动,瞬间CH3OH生成速率v(CH3OH)增大,但小于二氧化碳起始速率,恒温恒压下,与原平衡为等效平衡,平衡时二氧化碳的浓度相等,其速率与原平衡相等,由于二氧化碳与甲醇为1:1反应,故平衡时二氧化碳的生成速率与甲醇的生成速率相等,CH3OH生成速率v(CH3OH)与时间的关系曲线为: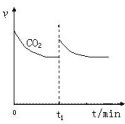 ,
,
故答案为: ;
;
②恒温恒容下,在原来的容器中加入2mol CO2和6mol H2,与开始加入1mol CO2和3mol H2相比,压强增大一倍,平衡正向移动,反应物转化率增大,则放出的热量b>2a,
故答案为:b>2a.
B.温度过高,碳酸氢钠、碳酸氢铵容易分解,不利于二氧化碳的捕捉,故B错误;
C.开放高效光催化剂分解水制氢气,可以降低能耗,故C正确;
D.捕捉到的CO2可制备其它化工产品,减少了温室气体排放,但碳酸钙分解能耗大,制备氢气能耗大,故D错误.
故选:BD;
(2)①不同温度条件下,t2、t3时刻混合气体总浓度不变,说明t2时刻均到达平衡,而升高温度平衡时混合气体总浓度增大,说明升高温度平衡正向移动,则正反应为吸热反应,
由方程式可知混合气体中氨气与二氧化碳的浓度之比为2:1,在25℃,0-t1时间内产生氨气浓度为2.7×10-3mol/L×
| 2 |
| 3 |
| 1.8×10-3mol/L |
| t1min |
| 1.8 |
| t1 |
故答案为:吸热;
| 1.8 |
| t1 |
②氨气与二氧化碳的浓度之比为2:1,15℃平衡时氨气浓度为2.4×10-3mol/L×
| 2 |
| 3 |
| 1 |
| c2(NH3)×c(CO2) |
| 1 |
| (1.6×10-3)2×8×10-4 |
故答案为:4.9×108;
(3)①向容器中再充入1mol CO2和3mol H2,平衡正向移动,瞬间CH3OH生成速率v(CH3OH)增大,但小于二氧化碳起始速率,恒温恒压下,与原平衡为等效平衡,平衡时二氧化碳的浓度相等,其速率与原平衡相等,由于二氧化碳与甲醇为1:1反应,故平衡时二氧化碳的生成速率与甲醇的生成速率相等,CH3OH生成速率v(CH3OH)与时间的关系曲线为:
 ,
,故答案为:
 ;
;②恒温恒容下,在原来的容器中加入2mol CO2和6mol H2,与开始加入1mol CO2和3mol H2相比,压强增大一倍,平衡正向移动,反应物转化率增大,则放出的热量b>2a,
故答案为:b>2a.
看了工业利用NaOH溶液或氨水喷淋...的网友还看了以下:
化学 多少度以上算高温 酒精灯焰头温度约为多少 酒精喷灯呢 为什么酒精喷灯温度比酒精 2020-04-06 …
如图示意某地的沉积岩层与火成岩体的相互关系.回答11~12题.喷出地表的火成岩为喷出岩,没有喷出地 2020-04-06 …
根据火山喷发状况划分为哪三种类型?A、裂隙式喷发、中心式喷发、宁静式喷发B、裂隙式喷发、中心式喷发 2020-06-17 …
火箭刚发射时,高温火焰向下喷向发射台地面,很多物体遇到这样高温的火焰将会.为保护发射台底,需要修建 2020-06-26 …
2013年11月20日开始,日本西之岛东南的海底火山发生强烈喷发,形成一座“新岛屿”.读图并结合所 2020-06-26 …
如图3所示是木星的一个卫星——木卫1上面的珞玑火山喷发的情景,图片中的英文单词Eruption意思 2020-07-22 …
读“等温线模式图”完成下列问题.(1)丙点的气温是℃,丁点的气温是℃,图中L处是温中心.(2)图中等 2020-11-02 …
2011年3月,日本发生了强烈地震并引发了海啸,对福岛核电站造成了很大的破坏,如图所示.(1)为了给 2020-12-10 …
火箭刚发射时,高温火焰向下喷到发射台的地面,很多物体遇到这样高温火焰将会.为了保护发射台底,就建了一 2020-12-15 …
火箭刚发射时,高温火焰向下喷到发射台的地面,很多物体遇到这样的高温火焰将会,为了保护发射台,在发射台 2020-12-15 …