早教吧作业答案频道 -->化学-->
废铅蓄电池量急速增加所引起的铅污染日益严重.工业上从废铅蓄电池的铅膏回收铅的工艺流程如下:已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.回答下列问题:(1)写出步骤
题目详情
废铅蓄电池量急速增加所引起的铅污染日益严重.工业上从废铅蓄电池的铅膏回收铅的工艺流程如下:
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
回答下列问题:
(1)写出步骤①中PbSO4转化为PbCO3过程的平衡常数表达式K=___,为提高步骤①的反应速率和铅浸出率,你认为可采取的两条措施是___、___.
(2)步骤①中发生的氧化还原反应的离子方程式为___.
(3)写出步骤④用惰性电极电解的阴极反应式___.
(4)PbO2在加热过程发生分解的失重曲线如图1所示,已知失重曲线上的a点为样品失重4.0%(即
×100%)的残留固体,若a点固体组成表示为PbOx,计算x=___.
(5)铅的加工同样会使水体中重金属铅的含量增大造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的浓度分数α随溶液pH变化的关系如图2所示,某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如表
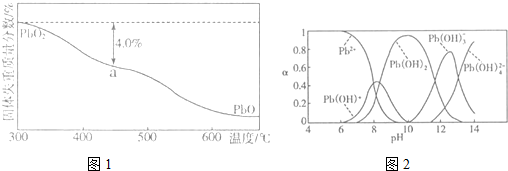
则上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是___,如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+⇌E2Pb(s)+2H+.则脱铅的最合适pH范围为___(填字母).
A.4~5 B.6~7 C.9~10 D.11~12.

已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
回答下列问题:
(1)写出步骤①中PbSO4转化为PbCO3过程的平衡常数表达式K=___,为提高步骤①的反应速率和铅浸出率,你认为可采取的两条措施是___、___.
(2)步骤①中发生的氧化还原反应的离子方程式为___.
(3)写出步骤④用惰性电极电解的阴极反应式___.
(4)PbO2在加热过程发生分解的失重曲线如图1所示,已知失重曲线上的a点为样品失重4.0%(即
| 样品起始质量-a点固体质量 |
| 样品起始质量 |
(5)铅的加工同样会使水体中重金属铅的含量增大造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的浓度分数α随溶液pH变化的关系如图2所示,某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如表

| 离子/(mol.L-1) | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度 | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度 | 0.004 | 22.6 | 0.040 | 0.053 | 49.9 |
A.4~5 B.6~7 C.9~10 D.11~12.
▼优质解答
答案和解析
(1)PbSO4转化为PbCO3方程式为:PbSO4(s)+CO32-(aq)⇌PbCO3(s)+SO42-(aq),平衡常数K=
,为了加快反应速率和铅浸出率,可以采取措施有:充分搅拌;适当升高温度;增大碳酸钠和亚硫酸钠的浓度等,
故答案为:
;充分搅拌;适当升高温度;增大碳酸钠和亚硫酸钠的浓度(任写两点);
(2)步骤①PbO2与亚硫酸钠发生氧化反应生成PbSO4,根据电荷守恒,可知还生成NaOH,反应离子方程为:PbO2+SO32-+H2O=PbSO4+2OH-,
故答案为:PbO2+SO32-+H2O=PbSO4+2OH-;
(3)阴极发生还原反应,Pb2+获得电子生成Pb,阴极电极反应式:Pb2++2e-=Pb,
故答案为:Pb2++2e-=Pb;
(4)加热分解过程固体中Pb元素质量不变,则100×
=96×
,解得x=1.4,
故答案为:1.4;
(5)Fe3+去除率为
×100%=67%,Ca2+去除率为
×100%=24%,Mn2+去除率为
×100%=39%,Cl-去除率为
×100%=3.9%,则除Pb2+外,该脱铅剂对其它离子的去除效果最好的是Fe3+,
反应为2EH(s)+Pb2+⇌E2Pb(s)+2H+,参加反应的是Pb2+,由图象可知,选择PH要使铅以Pb2+形式存在,酸性太强,正反应被抑制,去除效果降低,则脱铅时最合适的pH约6~7,
故答案为:B.
| c(SO42-) |
| c(CO32-) |
故答案为:
| c(SO42-) |
| c(CO32-) |
(2)步骤①PbO2与亚硫酸钠发生氧化反应生成PbSO4,根据电荷守恒,可知还生成NaOH,反应离子方程为:PbO2+SO32-+H2O=PbSO4+2OH-,
故答案为:PbO2+SO32-+H2O=PbSO4+2OH-;
(3)阴极发生还原反应,Pb2+获得电子生成Pb,阴极电极反应式:Pb2++2e-=Pb,
故答案为:Pb2++2e-=Pb;
(4)加热分解过程固体中Pb元素质量不变,则100×
| 207 |
| 207+32 |
| 207 |
| 207+16x |
故答案为:1.4;
(5)Fe3+去除率为
| 0.12-0.04 |
| 0.12 |
| 29.8-22.6 |
| 29.8 |
| 0.087-0.053 |
| 0.087 |
| 51.9-49.9 |
| 51.9 |
反应为2EH(s)+Pb2+⇌E2Pb(s)+2H+,参加反应的是Pb2+,由图象可知,选择PH要使铅以Pb2+形式存在,酸性太强,正反应被抑制,去除效果降低,则脱铅时最合适的pH约6~7,
故答案为:B.
看了废铅蓄电池量急速增加所引起的铅...的网友还看了以下:
根据以下经济业务编制会计分录1:1日,从长红工厂购甲材料300千克,单价200元,增值税进项税额为 2020-04-06 …
东方红小学2012年的升旗时间因日期不同而不同,规定:1月1日到1月10日恒定为早晨7:13;1月 2020-04-11 …
某地的防汛计划,从6月10日0时起,开启1号水闸蓄说,每天经过1号水闸流入水库为6万立方米.从6月 2020-06-21 …
三峡大坝从6月1号开始下闸蓄水,下表是工作人员连续5天的水位记录(如果规定蓄水位为135米)情况, 2020-06-30 …
(数学题)林先生买进某公司股票7000股,每股27元,下表为本周内每日该股票的涨跌情况单位(元)14 2020-11-06 …
从理论上计算当日期货价格为多少假设年利率为6%,年指数股息率为1%,6月30日为6月期货合约的交割日 2020-11-06 …
记者近日从财政部关税司获悉,2007年,我国进出口税收持续快速增长,全国海关征收关税和进口环节税净入 2020-11-27 …
会计科目的问题要求有详解某公司为增值税一般纳税人,税率17%,6月份发生以下经济业务(1)3日从银行 2020-11-30 …
2014年12月9日至11日,中央经济工作会议全面阐述了我国经济发展新常态。下列描述不符合我国经济发 2020-12-15 …
从2012年1月1日起,我国在部分地区和行业开展深化增值税制度改革试点,将目前征收营业税的行业逐步改 2021-01-01 …