早教吧作业答案频道 -->化学-->
短周期的五种元素A、B、C、D、E,原子序数依次增大.A、B、C三种元素电子层数之和是5.A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它
题目详情
短周期的五种元素A、B、C、D、E,原子序数依次增大.A、B、C三种元素电子层数之和是5.A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1:1和2:1的两种液态化合物;E单质用于净化水质.
请回答:
(1)写出D在元素周期表中的位置___,E的原子结构示意图是___.下列可以验证C与D两元素原子得电子能力强弱的实验事实是___(填写编号).
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式___.
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为___,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___.
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___.
②上述反应生成的两种碱继续作用,得到Fe3O4.
(5)已知下表数据:
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0mol•L-1,则混合液中c(OH-)不得大于___ mol•L-1.
请回答:
(1)写出D在元素周期表中的位置___,E的原子结构示意图是___.下列可以验证C与D两元素原子得电子能力强弱的实验事实是___(填写编号).
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式___.
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为___,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___.
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___.
②上述反应生成的两种碱继续作用,得到Fe3O4.
(5)已知下表数据:
| 物质 | Fe(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 2.0×10-16 | 4.0×10-36 |
▼优质解答
答案和解析
短周期元素A、B、C、D、E原子序数依次增大,B元素原子最外电子层上的电子数是它的电子层数的2倍,则B为碳元素或硫元素,因为B后面有C、D、E三种元素都是短周期元素,所以B为C元素;A与D可以形成原子个数比分别为1:1和2:1的两种液态化合物,则A为H元素,D为O元素;由于C元素原子序数介于B、D之间,所以C为N元素,E单质用于净化水质,则E为氯Cl元素,
(1)D为O元素,在元素周期表中位于第二周期VIA族;E为Cl元素,氯原子的核电荷数为17,最外层含有7个电子,氯原子结构示意图为: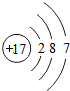 ;
;
A.氢化物的沸点与非金属性强弱没有必然关系,所以无法通过比较这两种元素的气态氢化物的沸点判断非金属性强弱,故A错误;
B.D为O元素、C为D元素,比较只有这两种元素所形成的化合物中的化合价,显示负价的说明其非金属性较强,故B正确;
C.非金属性越强,对应的气态氢化物越稳定,可以通过比较这两种元素的气态氢化物的稳定性判断其非金属性强弱,故C正确;
D.非金属性越强,与氢气形成气态氢化物越容易,可以通过比较这两种元素的单质与氢气化合的难易判断其非金属性强弱,故D正确;
故答案为:第二周期VIA族; ;BCD;
;BCD;
(2)由A、B两种元素组成的最简单的化合物为甲烷,甲烷为共价化合物,其电子式为: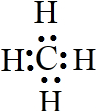 ,
,
故答案为: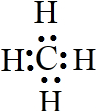 ;
;
(3)由A、B、C、D四种元素组成的无机盐甲,既能与盐酸反应又可以与NaOH溶液反应,其化学式为 NH4HCO3或(NH4)2 CO3;
乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,则乙为甘氨酸,其化学式为:NH2-CH2-COOH,
故答案为:NH4HCO3或(NH4)2CO3;NH2-CH2-COOH;
(4)①CA3为氨气,NH3的水溶液显碱性,可以将Fe2+、Fe3+转化成Fe(OH)2和Fe(OH)3沉淀,在等物质的量的FeSO4和Fe2(SO4)3组成的混合溶液中,反应总离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
(5)亚铁离子和铁离子的浓度分别是2.0mol/L和4.0mol/L,所以根据溶度积常数可知,相应OH-浓度分别为:
mol/L=10-8mol/L、
mol/L=10-12mol/L,所以混合液中c(OH-)不得大于10-12mol/L,
故答案为:10-12.
(1)D为O元素,在元素周期表中位于第二周期VIA族;E为Cl元素,氯原子的核电荷数为17,最外层含有7个电子,氯原子结构示意图为:
 ;
;A.氢化物的沸点与非金属性强弱没有必然关系,所以无法通过比较这两种元素的气态氢化物的沸点判断非金属性强弱,故A错误;
B.D为O元素、C为D元素,比较只有这两种元素所形成的化合物中的化合价,显示负价的说明其非金属性较强,故B正确;
C.非金属性越强,对应的气态氢化物越稳定,可以通过比较这两种元素的气态氢化物的稳定性判断其非金属性强弱,故C正确;
D.非金属性越强,与氢气形成气态氢化物越容易,可以通过比较这两种元素的单质与氢气化合的难易判断其非金属性强弱,故D正确;
故答案为:第二周期VIA族;
 ;BCD;
;BCD;(2)由A、B两种元素组成的最简单的化合物为甲烷,甲烷为共价化合物,其电子式为:
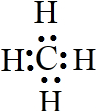 ,
,故答案为:
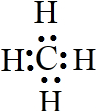 ;
;(3)由A、B、C、D四种元素组成的无机盐甲,既能与盐酸反应又可以与NaOH溶液反应,其化学式为 NH4HCO3或(NH4)2 CO3;
乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,则乙为甘氨酸,其化学式为:NH2-CH2-COOH,
故答案为:NH4HCO3或(NH4)2CO3;NH2-CH2-COOH;
(4)①CA3为氨气,NH3的水溶液显碱性,可以将Fe2+、Fe3+转化成Fe(OH)2和Fe(OH)3沉淀,在等物质的量的FeSO4和Fe2(SO4)3组成的混合溶液中,反应总离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
(5)亚铁离子和铁离子的浓度分别是2.0mol/L和4.0mol/L,所以根据溶度积常数可知,相应OH-浓度分别为:
|
| 3 |
| ||
故答案为:10-12.
看了短周期的五种元素A、B、C、D...的网友还看了以下:
如图是雌激素与相应受体结合情况示意图,以下叙述错误的是()A.由图可知雌激素相应的受体在细胞内B. 2020-06-13 …
A、B、C三种元素,A元素的单质是最清洁的燃料;B元素的单质能在C元素的单质中剧烈燃烧,火星四射, 2020-07-14 …
(5分)有A、B、C、D四种元素,A元素的原子没有中子;B元素的离子结构示意图如右图所示;C+的核 2020-07-29 …
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为.(2)B元素的负一价 2020-07-29 …
下列关于人体激素的叙述,正确的是()A.激素通过体液定向传送到靶细胞并对靶细胞发挥作用B.激素在人体 2020-11-20 …
能说明A元素的非金属性比B元素的非金属性强的是()A、A原子得到电子的数目比B原子少B、A元素的最高 2020-12-20 …
在A、B、C、D四种元素中,A元素的原子核外只有一个电子,B元素是地壳中含量最多的元素,C元素是地壳 2021-02-01 …
A、B、C三种元素,A元素组成的单质是自然界最硬的物质,B元素是海水中含量最多的元素,C元素组成的单 2021-02-09 …
A、B、C、D四种元素,A元素的单质是最轻的稀有气体,可以填充气球,B元素的一种单质是自然界中最硬的 2021-02-09 …
A、B、C、D四种元素,A元素的单质是最轻的稀有气体,可以填充气球,B元素的一种单质是自然界中最硬的 2021-02-09 …