早教吧作业答案频道 -->化学-->
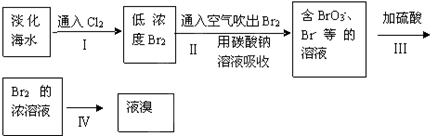
溴主要以Br-形式存在于海水中,从淡化海水中提取溴的流程如图:完成下列填空:(1)写出步骤Ⅰ中反应的离子方程式.(2)步骤Ⅰ中应在通风橱中进行,目的是.(3)步骤Ⅱ发生下
题目详情
溴主要以Br-形式存在于海水中,从淡化海水中提取溴的流程如图:
完成下列填空:
(1)写出步骤Ⅰ中反应的离子方程式___.
(2)步骤Ⅰ中应在通风橱中进行,目的是___.
(3)步骤Ⅱ发生下列反应,请完成下列反应式:3Br2+3Na2CO3=___+NaBrO3+3CO2↑
(4)步骤Ⅲ发生如下反应,用双线法标出电子转移情况:3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O
该反应的氧化剂是___.
(5)步骤Ⅳ的操作有蒸馏和___.A.分液 B.结晶 C.过滤 D.蒸发
(6)每获得1molBr2,需消耗5mol/L的硫酸___L.

完成下列填空:
(1)写出步骤Ⅰ中反应的离子方程式___.
(2)步骤Ⅰ中应在通风橱中进行,目的是___.
(3)步骤Ⅱ发生下列反应,请完成下列反应式:3Br2+3Na2CO3=___+NaBrO3+3CO2↑
(4)步骤Ⅲ发生如下反应,用双线法标出电子转移情况:3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O
该反应的氧化剂是___.
(5)步骤Ⅳ的操作有蒸馏和___.A.分液 B.结晶 C.过滤 D.蒸发
(6)每获得1molBr2,需消耗5mol/L的硫酸___L.
▼优质解答
答案和解析
(1)氯气氧化性大于溴单质,氯气可以氧化溴离子为溴单质,离子反应为:2Br-+Cl2═Br2+2Cl-,
故答案为:2Br-+Cl2═Br2+2Cl-;
(2)有毒气体应有完全吸收处理装置,氯气、溴单质有毒,要在通风橱中进行,为了防止中毒,要及时将气体排出,
故答案为:防止中毒;
(3)用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒得方程式为:3Br2+3Na2CO3═NaBrO3+5NaBr+3CO2↑,
故答案为:5NaBr;
(4)5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O中,NaBr中Br元素的化合价由-1价升高为0,为还原剂,NaBrO3中Br元素的化合价由+5价降低为0,为氧化剂,电子转移情况为: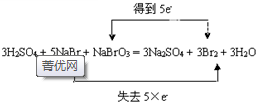 ,
,
故答案为: ;NaBrO3;
;NaBrO3;
(5)溴为易溶于有机溶剂的单质,溴的浓溶液,经萃取、分液、蒸馏,可得到液溴,
故答案为:分液;
(6)加硫酸酸化:5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O,得到溴的浓溶液,每获得1molBr2,需消耗1ol的硫酸,根据V(H2SO4)=
=
=0.2L,
故答案为:0.2L.
故答案为:2Br-+Cl2═Br2+2Cl-;
(2)有毒气体应有完全吸收处理装置,氯气、溴单质有毒,要在通风橱中进行,为了防止中毒,要及时将气体排出,
故答案为:防止中毒;
(3)用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2,该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒得方程式为:3Br2+3Na2CO3═NaBrO3+5NaBr+3CO2↑,
故答案为:5NaBr;
(4)5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O中,NaBr中Br元素的化合价由-1价升高为0,为还原剂,NaBrO3中Br元素的化合价由+5价降低为0,为氧化剂,电子转移情况为:
 ,
,故答案为:
 ;NaBrO3;
;NaBrO3;(5)溴为易溶于有机溶剂的单质,溴的浓溶液,经萃取、分液、蒸馏,可得到液溴,
故答案为:分液;
(6)加硫酸酸化:5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O,得到溴的浓溶液,每获得1molBr2,需消耗1ol的硫酸,根据V(H2SO4)=
| n |
| c |
| 1mol |
| 5mol/L |
故答案为:0.2L.
看了溴主要以Br-形式存在于海水中...的网友还看了以下:
在平行四边形ABCD中,E,F分别是边AD,BC上的一点,且AE=CF,AF与BE相交于点N,EF 2020-05-16 …
某学习小组同学做了“海带成分中碘的检验”的实验。实验步骤如下:回答:(1)灼烧海带所用到的仪器有: 2020-05-16 …
如图为某学生进行某实验的基本操作步骤,下列相关表述错误的是()A.该实验的目的是观察细胞的有丝分裂 2020-06-19 …
如图所示是自来水厂净化水的主要步骤.下列有关说法中不正确的是()A.步骤①中可加入明矾作絮凝剂B. 2020-06-23 …
下表是某同学关于酶特性的实验操作步骤,下列分析正确的是()步骤项目试管甲乙1注入可溶性淀粉溶液2m 2020-07-15 …
下列关于海洋资源的正确叙述是①发展海水淡化技术、向海洋要淡水,是解决世界淡下列关于海洋资源的正确叙述 2020-11-20 …
实验室制备四水甲酸铜[Cu(HCOO)2•4H2O]晶体实验步骤如下.(1)碱式碳酸铜的制备:a.步 2020-12-04 …
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤 2020-12-14 …
(2011•东城区模拟)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂 2020-12-24 …
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤 2020-12-24 …