化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)
化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的 SO 2 是大气中 SO 2 的主要来源。
(1) 将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为 C(s) + H 2 O(g) CO(g) + H 2 (g) ,该反应的化学平衡常数表达式为 K = ________ 。
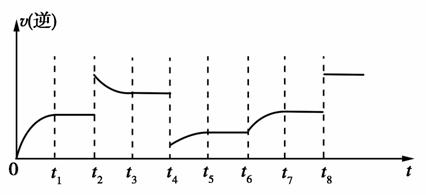
若反应的逆反应速率与时间的关系如图所示:
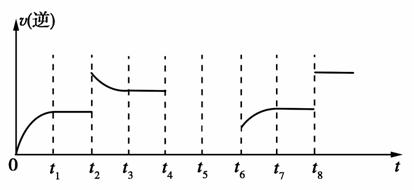
① 可见反应在 t 1 、 t 3 、 t 7 ,时都达到了平衡,而 t 2 、 t 8 时都改变了一种条件,试判断 t 2 时改变的是什么条件: t 2 时 ________________ 。
② 若 t 4 时降压, t 6 时增大反应物的浓度,请在图中画出 t 4 ~ t 6 时逆反应速率与时间的关系线。
(2) 碘循环工艺不仅能吸收 SO 2 降低环境污染,同时又能制得氢气,具体流程如下:
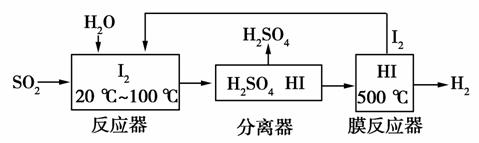
① 用离子方程式表示反应器中发生的反应: ________________ 。
② 用化学平衡移动的原理分析,在 HI 分解反应中使用膜反应器分离出 H 2 的目的是 ________________ 。
解析: (1) 固体不写入平衡常数表达式中。 ① 观察图像可知 t 2 时逆反应速率突然增大,并且平衡逆向移动,所以改变的条件可能是增大压强或增大生成物浓度。该反应是吸热反应,升高温度平衡正向移动,而加入催化剂对平衡移动无影响,所以不可能是升高温度或使用催化剂。 ② 若 t 4 时降压,正、逆反应速率突然减小,平衡正向移动,正反应速率大于逆反应速率,在趋于平衡的过程中逆反应速率逐渐增大,平衡时与 t 6 时 v ( 逆 ) 相等。 (2) ① 反应器中发生反应的化学方程式为 I 2 + SO 2 + 2H 2 O == =H 2 SO 4 + 2HI ,改写成离子方程式即可。 ② 该循环工艺的目的之一是制备氢气,而 HI 分解生成 H 2 与 I 2 (g) 的反应是可逆反应,为了增大 H 2 的产率,使平衡正向移动,需要不断地分离出氢气。
答案 : (1) c (CO)· c (H 2 )/ c (H 2 O)(2 分 )
① 增大压强或增大生成物浓度 (2 分 )
②
(2) ① SO 2 + I 2 + 2H 2 O == =4H + + SO ![]() + 2I - (2 分 )
+ 2I - (2 分 )
② 降低生成物的浓度,使平衡正向移动 (2 分 )
.《秋水》这则寓言蕴含了怎样的道理?你从中受到了那些启发?、要简洁的回答 2020-03-30 …
中国汉字的由来,要简洁的. 2020-05-14 …
求几句激励人的古代名言,不要太多了,要简洁的 2020-05-16 …
求3*3魔方最后一公式,要“上左”“下右”这样的公式,不要英文,要简洁的上下两个面同色,旁边的有3 2020-05-16 …
答对加分:全球变暖的英文标语关于全球变暖的英文标语,要简洁的,最好一句话就几个词,然后比较有冲击力 2020-05-16 …
中国民族工业的黄金时期出现的主要原因要简洁的. 2020-05-16 …
建筑物用薄壳结构的好处要简洁的!越简洁越好! 2020-05-16 …
苍蝇、蚊子、蜜蜂的飞行有什么特点呢? 快!要简洁的! 2020-05-17 …
天上偷来的火种主要内容要简洁的,字数少一点 2020-05-20 …
关于于谦廉洁和爱国方面的小故事(要简洁的,两方面各一个)急! 2020-06-11 …