早教吧作业答案频道 -->化学-->
硫化氢在科研、生活及化学工业中均有重要应用.(1)已知:H2S电离常数:K1=1.3×10-7,K2=7.0×10-15,在废水处理领域中,H2S能使某些金属离子生成难溶硫化物而除去.250C时,0.1mol.L-
题目详情
硫化氢在科研、生活及化学工业中均有重要应用.
(1)已知:H2S电离常数:K1=1.3×10-7,K2=7.0×10 -15,在废水处理领域中,H2S能使某些金属离子生成难溶硫化物而除去.250C时,0.1mol.L-1H2S溶液pH为(取近似整数)___;向含有0.020mol.L-lMn2+的废水中通入一定量H2S气体,调节溶液的pH=5,当HS-浓度为1.0×10-4mol•L一1时,Mn2+开始沉淀,则MnS的溶度积为___.
(2)工业上采用高温分解H2S制取氢气,在膜反应器中分离出H2.其反应为
2H2S(g)⇌2H2 (g)+S2 (g)△H1
已知:H2S(g)⇌H2(g)+S(g)△H2 2S(g)⇌S2 (g)△H3
则△H1=(用含△H2、△H3式子表示)
(3)在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2s起始浓度均为c mol•L-1测定H2S的转化率,结果如图1所示.图中a曲线表示H2S的平衡转化率与温度的关系,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.由图可知:2H2 S(g)⇌2H2 (g)+S2 (g)△H1___0(填“>”、“<”或
“=”);在985℃时,该反应经过时间t s达到平衡状态,反应速率v(H2)为___,反应的平衡常数K为___;H2S分解随温度升高,曲线b向曲线a逼近的原因是___.
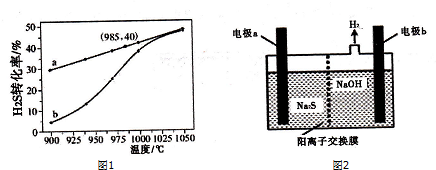
(4)H2S废气可用足量烧碱溶液吸收,将吸收后的溶液加入如图2所示电解池中进行电解,在阳极区可生成Sn2-.试写出生成Sn2-的反应方程式___.
(1)已知:H2S电离常数:K1=1.3×10-7,K2=7.0×10 -15,在废水处理领域中,H2S能使某些金属离子生成难溶硫化物而除去.250C时,0.1mol.L-1H2S溶液pH为(取近似整数)___;向含有0.020mol.L-lMn2+的废水中通入一定量H2S气体,调节溶液的pH=5,当HS-浓度为1.0×10-4mol•L一1时,Mn2+开始沉淀,则MnS的溶度积为___.
(2)工业上采用高温分解H2S制取氢气,在膜反应器中分离出H2.其反应为
2H2S(g)⇌2H2 (g)+S2 (g)△H1
已知:H2S(g)⇌H2(g)+S(g)△H2 2S(g)⇌S2 (g)△H3
则△H1=(用含△H2、△H3式子表示)
(3)在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2s起始浓度均为c mol•L-1测定H2S的转化率,结果如图1所示.图中a曲线表示H2S的平衡转化率与温度的关系,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.由图可知:2H2 S(g)⇌2H2 (g)+S2 (g)△H1___0(填“>”、“<”或
“=”);在985℃时,该反应经过时间t s达到平衡状态,反应速率v(H2)为___,反应的平衡常数K为___;H2S分解随温度升高,曲线b向曲线a逼近的原因是___.

(4)H2S废气可用足量烧碱溶液吸收,将吸收后的溶液加入如图2所示电解池中进行电解,在阳极区可生成Sn2-.试写出生成Sn2-的反应方程式___.
▼优质解答
答案和解析
(1)已知:H2S电离常数:K1=1.3×10-7,250C时,0.1mol.L-1H2S溶液中,设氢离子浓度是x,根据H2S⇌2H++HS-,则:
=1.3×10-7,解得x=
×10-4,所以pH≈4,当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=5,H2S电离常数:K2=7.0×10-15,当HS-浓度为1.0×10-4mol•L-1时,c(S2-)=7×10-12mol•L-1,
所以Ksp=c(Mn2+)•c(S2-)=7×10-12mol•L-1×0.020mol.L-1=2.8×10-13,故答案为:4;2.8×10-13;
(2)已知:①H2S(g)⇌H2(g)+S(g)△H2
②2S(g)⇌S2 (g)△H3
反应:2H2S(g)⇌2H2 (g)+S2 (g)可以根据①×2+②得到,所以△H1=2△H2+△H3,故答案为:△H1=2△H2+△H3;
(3)由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,H2S的起始浓度均为c mol•L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol•L-1×40%=0.4cmol•L-1,v=
=
mol•L-1•min-1;以H2S起始浓度均为cmol•L-1测定H2S的转化率,985℃时H2S的转化率为40%,则
2H2S(g)⇌2H2(g)+S2(g),
开始 c 0 0
转化 0.4c 0.4c 0.2c
平衡0.6c 0.4c 0.2c
K=
=
;随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
故答案为:>;
;
;温度升高,反应速率加快,达到平衡所需时间缩短.
(4)电解过程中阳极区发生如下反应:S2--2e-═S,溶液中发生反应(n-1)S+S2-═Sn2-,故答案为:(n-1)S+S2-═Sn2-.
| x2 |
| 0.1 |
| 1.3 |
所以Ksp=c(Mn2+)•c(S2-)=7×10-12mol•L-1×0.020mol.L-1=2.8×10-13,故答案为:4;2.8×10-13;
(2)已知:①H2S(g)⇌H2(g)+S(g)△H2
②2S(g)⇌S2 (g)△H3
反应:2H2S(g)⇌2H2 (g)+S2 (g)可以根据①×2+②得到,所以△H1=2△H2+△H3,故答案为:△H1=2△H2+△H3;
(3)由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,H2S的起始浓度均为c mol•L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol•L-1×40%=0.4cmol•L-1,v=
| △c |
| △t |
| 0.4c |
| t |
2H2S(g)⇌2H2(g)+S2(g),
开始 c 0 0
转化 0.4c 0.4c 0.2c
平衡0.6c 0.4c 0.2c
K=
| 0.2c×(0.4c)2 |
| (0.6c)2 |
| 0.8c |
| 9 |
故答案为:>;
| 0.4c |
| t |
| 0.8c |
| 9 |
(4)电解过程中阳极区发生如下反应:S2--2e-═S,溶液中发生反应(n-1)S+S2-═Sn2-,故答案为:(n-1)S+S2-═Sn2-.
看了硫化氢在科研、生活及化学工业中...的网友还看了以下:
同学们,你能用你学过的单词完成下列题目吗?h()1格h()2格h()3格h()4格h()5格h() 2020-07-09 …
请老师编写通达信公式?均5:=MA(C,5);均10:=MA(C,10);均60:=MA(C,60 2020-07-18 …
C关于自加结果#includevoidmain(){intj=5,k=5,h=5,q,r,s;q= 2020-07-23 …
导数题设f(5)=5,f'(5)=3,g(5)=4,g'(5)=1在下列情况下求h(5)和h'(5 2020-07-30 …
求一选股公式,条件如下:1、25均线大于前一日25均线;2、5均线不小于25均线;3、5量线不小于6 2020-10-30 …
SUMIF(购入!$E$5:$E$584,C7,购入!$H$5:$H$58)谁能帮我解释下$H$5: 2020-10-31 …
excel中这个公式如何用,=$H$2*E2+$H$3*E3+$H$4*E4+$H$5*E5+$H$ 2020-10-31 …
计算:(1)(-1八)+15;(5)(-八.9)+(-3.i);(3)八+(-h.5);(h)15- 2020-11-01 …
土方计算题求帮忙,要公式和步骤,答的好有追分某桥墩基础施工,地质为砂粘土、基坑土方采用人工配合机械开 2020-11-07 …
下列说法正确的是()A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9mol/ 2021-02-01 …