早教吧作业答案频道 -->化学-->
甲醇是一种重要的可再生能源,可以通过下列反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g).(1)甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应
题目详情
甲醇是一种重要的可再生能源,可以通过下列反应制备甲醇:CO(g)+2H2(g)⇌CH3OH(g).
(1)甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率υ(H2)=___.
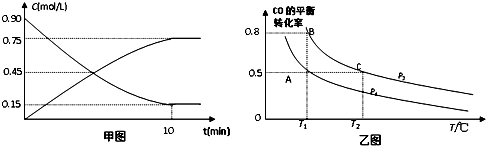
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法能判断该反应达到化学平衡状态的是___.
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中混合气体的密度不再改变
D.体系中气体的平均摩尔质量不再改变
②比较A、B、C三点化学反应速率由大到小顺序是___.
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=___L.
(3)已知2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式___.
(1)甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率υ(H2)=___.

(2)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法能判断该反应达到化学平衡状态的是___.
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中混合气体的密度不再改变
D.体系中气体的平均摩尔质量不再改变
②比较A、B、C三点化学反应速率由大到小顺序是___.
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=___L.
(3)已知2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式___.
▼优质解答
答案和解析
(1)用甲醇表示的反应速率v=
=0.075mol/(L•min),氢气表示的反应速率是甲醇的2倍,即0.15mol/(L•min),故答案为:0.15mol/(L•min);
(2)①A.H2的消耗速率等于CH3OH的生成速率的2倍,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.因为质量一直不变,但体积在变,所以体系中混合气体的密度不再改变,达到了平衡,故C正确;
D.体系中气体的平均摩尔质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,故D正确.
故选BCD.
②根据C的温度高于B,则反应速率C高于B;根据该反应压强越大,CO平衡转化率越大,所以B的压强大于A,则反应速率B高于A,所以A、B、C三点化学反应速率由大到小顺序是υ(C)>υ(B)>υ(A),故答案为:υ(C)>υ(B)>υ(A);
③A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)⇌CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=
=4,V=4L,
故答案为:4L;
(3)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
| 0.75mol/L |
| 10min |
(2)①A.H2的消耗速率等于CH3OH的生成速率的2倍,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.因为质量一直不变,但体积在变,所以体系中混合气体的密度不再改变,达到了平衡,故C正确;
D.体系中气体的平均摩尔质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,故D正确.
故选BCD.
②根据C的温度高于B,则反应速率C高于B;根据该反应压强越大,CO平衡转化率越大,所以B的压强大于A,则反应速率B高于A,所以A、B、C三点化学反应速率由大到小顺序是υ(C)>υ(B)>υ(A),故答案为:υ(C)>υ(B)>υ(A);
③A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)⇌CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=
| ||||
|
故答案为:4L;
(3)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
看了甲醇是一种重要的可再生能源,可...的网友还看了以下:
2011江苏高考19题高氯酸按(NHClO)是复合火箭推进剂的重要成分,实验室可通过下列反应制取高 2020-04-26 …
Fe2O3在工业上有重要的用途,可发生如图所示的一系列反应.下列说法正确的是()A.Fe2O3与A 2020-05-15 …
求助!填词,哪位大神能化腐朽为神奇?流流不流泪,掉掉不掉队.PS:空白处填字也可打乱顺序重排列~反 2020-06-07 …
36.下列关于累计凭证的说法中,正确的有().A.累计凭证是在一定时期不断重复地反映不36.下列关 2020-06-10 …
物质H俗称衣康酸,是制备高效粘合剂等多种精细化学品的重要原料,可经下列反应路线得到:回答下列问题: 2020-06-20 …
下列四句话中错误的是()A.地球上同一位置,重力与质量成正比.B.重力的方向垂直与支持面.C.重力 2020-06-29 …
甲苯是一种重要的化工原料.某化学实验小组从甲苯经一系列反应合成了化合物C.已知:请完成下列各题:( 2020-07-22 …
甲苯是一种重要的化工原料.某化学实验小组从甲苯经一系列反应合成了化合物C.已知:请完成下列各题:( 2020-07-29 …
(2012•连云港三模)铝是一种很重要的金属,可以发生一系列反应制备物质,如图所示.下列说法错误的是 2020-11-12 …
下列反应适用于实验室制备重氨(ND3)的是()A.重氢气(D2)与氮气合成法B.重水(D2O)与 2020-12-05 …