早教吧作业答案频道 -->化学-->
海水资源的开发与利用具有广阔的前景,海水的pH一般在7.5~8.6之间.某地海水中主要离子的含量如表:成分Na+K+Ca2+Mg2+Cl-SO42-HCO3-含量/mg•L-1936083160
题目详情
海水资源的开发与利用具有广阔的前景,海水的pH一般在7.5~8.6之间.某地海水中主要离子的含量如表:
(1)海水显弱碱性的原因是(用离子方程式表示):___,该海水中Ca2+的物质的量浓度为___mol/L.
(2)下面是海水利用电渗析法获得淡水的原理图,电极为惰性电极.请分析下列问题:
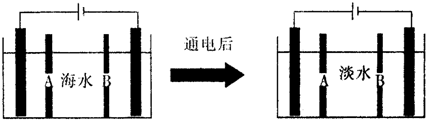
①阳离子交换膜是指___(填A或B).
②写出通电后阳极区的电极反应式:___.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式___.
(3)水的净化与软化的区别是___;离子交换法是软化水的常用方法,聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式___.
(4)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收80g Br2时转移的电子为___mol.
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(2)下面是海水利用电渗析法获得淡水的原理图,电极为惰性电极.请分析下列问题:

①阳离子交换膜是指___(填A或B).
②写出通电后阳极区的电极反应式:___.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式___.
(3)水的净化与软化的区别是___;离子交换法是软化水的常用方法,聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式___.
(4)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收80g Br2时转移的电子为___mol.
▼优质解答
答案和解析
(1)海水中存在的离子性质判断,碳酸氢根离子是弱酸阴离子水解显碱性,离子方程式为:HCO3-+H2O⇌H2CO3+OH-,结合海水中钙离子含量为160mg/L,物质的量浓度=
=4×10-3 mol/L;
故答案为:HCO3-+H2O⇌H2CO3+OH-;4×10-3 ;
(2)①阴极上是阳离子得到电子发生还原反应,氢离子放电能力大于钠离子,所以电极反应为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑,阳离子交换膜是指的是装置中B一端交换膜,
故答案为:B;
②阳极区是海水中的氯离子失电子发生氧化反应生成氯气,电极反应为:2Cl--2e-=Cl2↑,阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:2Cl--2e-=Cl2↑;Ca2++OH-+HCO3-=CaCO3↓+H2O;
(3)水的净化是除去悬浮性杂质,一般用明矾水解生成的氢氧化铝胶体有吸附悬浮杂质进行净水;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,聚丙烯酸钠是丙烯酸钠加聚反应的产物,则单体为丙烯酸钠,结构简式为:CH2=CHCOONa,
故答案为:水的净化是通过混凝剂(如明矾等)将水中的胶体及悬浮物除去,而水的软化是使水中的Ca2+、Mg2+浓度减小;CH2=CHCOONa;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收80gBr2物质的量=
=0.5mol,1mol Br2时,转移的电子数为1mol×2×
×5=
mol,则生成0.5mol Br2时,转移的电子数为
mol
故答案为:
.
| ||
| 1L |
故答案为:HCO3-+H2O⇌H2CO3+OH-;4×10-3 ;
(2)①阴极上是阳离子得到电子发生还原反应,氢离子放电能力大于钠离子,所以电极反应为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑,阳离子交换膜是指的是装置中B一端交换膜,
故答案为:B;
②阳极区是海水中的氯离子失电子发生氧化反应生成氯气,电极反应为:2Cl--2e-=Cl2↑,阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:2Cl--2e-=Cl2↑;Ca2++OH-+HCO3-=CaCO3↓+H2O;
(3)水的净化是除去悬浮性杂质,一般用明矾水解生成的氢氧化铝胶体有吸附悬浮杂质进行净水;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,聚丙烯酸钠是丙烯酸钠加聚反应的产物,则单体为丙烯酸钠,结构简式为:CH2=CHCOONa,
故答案为:水的净化是通过混凝剂(如明矾等)将水中的胶体及悬浮物除去,而水的软化是使水中的Ca2+、Mg2+浓度减小;CH2=CHCOONa;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收80gBr2物质的量=
| 80g |
| 160g/mol |
| 1 |
| 1+5 |
| 5 |
| 3 |
| 5 |
| 6 |
故答案为:
| 5 |
| 6 |
看了海水资源的开发与利用具有广阔的...的网友还看了以下:
7月18日,稽查员尚剑和陈芸前往某水泥加工厂送税务处理决定书,水泥加工厂总经理王某拒绝签收。7 2020-05-19 …
信息:6月1日长江三峡蓄水之前,坝前水位一般枯水期是65米,洪水期是75米.6月1日,长江三峡工程 2020-06-24 …
(8分)质量为M的小船以速度v0行驶,船上有两个质量皆为m的小孩a和b,分别静止站在般头和船尾。现 2020-06-26 …
养七彩神仙鱼,水缸浑浊程绿色,应该怎么办?对鱼有生命威胁吗?我养了七彩神仙2年了,有7条,缸水一直 2020-06-29 …
中砂的一般含水率是多少?8.7%算高吗?如题,还有做砂的含水率实验要取多少g样? 2020-07-10 …
如图为某河流局部水系及甲地月平均径流量曲线和降水量柱状图。完成下题(7分)。据图信息推测该地气候类型 2020-11-26 …
五年级下数学丛书第27面跳一跳怎么写,题目是把一个长15宽7高7水高7的长方体倒过来,问倒过来后的高 2020-12-04 …
通常不指明溶剂的溶液,一般是水溶液水是混合物,既然水都不是溶液了,为什么还称“水溶液”?前面讲错了一 2020-12-06 …
印染水解PH值出水比进水高是怎么回事我们进水COD在2500左右,水解进水PH在6-7,水解出水在9 2020-12-31 …
在实验室中做电解水实验时,为了增强水的导电性,一般在水中加入少量的氢氧化钠(并不参加反应).通电之前 2021-01-13 …