早教吧作业答案频道 -->化学-->
天然碱的主要成分是碳酸钠和碳酸氢钠.以天然碱为原料制备氢氧化钠的工艺流程可简单表示如图1所示:(1)碳酸钠俗称,其主要用途有(写出一种即可).(2)实验室进行溶解操作
题目详情
天然碱的主要成分是碳酸钠和碳酸氢钠.以天然碱为原料制备氢氧化钠的工艺流程可简单表示如图1所示:
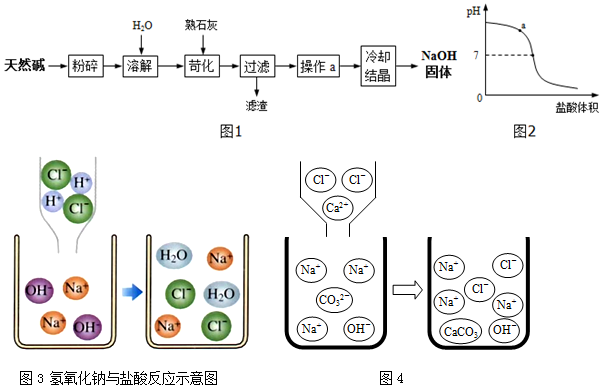
(1)碳酸钠俗称___,其主要用途有___(写出一种即可).
(2)实验室进行溶解操作时,使用玻璃棒的主要目的是___;操作a的名称是___.
(3)“苛化”时主要发生两个化学反应,其一为:NaHCO3+Ca(OH)2═NaOH+CaCO3↓+H2O;另一化学反应方程式为:___,该反应属于___(填基本反应类型).
(4)某化学兴趣小组同学为了测定产品NaOH固体(含少量碳酸钠)中NaOH的质量分数,进行了如下实验:
Ⅰ.称取NaOH固体样品2.15g,加适量水使之完全溶解.
Ⅱ.向上述溶液中滴加CaCl2溶液至不再产生白色沉淀,过滤.
Ⅲ.向滤液中加入质量分数为10.0%的盐酸溶液,所加盐酸溶液的体积与溶液的pH关系如图2所示.
回答下列问题:
①图中a点溶液中所含的阴离子有___(填离子符号).
②如图3是氢氧化钠与盐酸反应示意图,该反应的本质可以表示为OH-+H+=H2O.步骤Ⅱ中反应的示意图如图4,则该反应的本质可以表示为:___.
③已知氯化钠、氯化钙溶液均呈中性.当所加入的盐酸溶液质量为18.25g时,溶液的pH=7,则NaOH固体样品中NaOH的质量分数是___.(写出计算过程,否则不得分.结果以百分比表示,保留3位有效数字)

(1)碳酸钠俗称___,其主要用途有___(写出一种即可).
(2)实验室进行溶解操作时,使用玻璃棒的主要目的是___;操作a的名称是___.
(3)“苛化”时主要发生两个化学反应,其一为:NaHCO3+Ca(OH)2═NaOH+CaCO3↓+H2O;另一化学反应方程式为:___,该反应属于___(填基本反应类型).
(4)某化学兴趣小组同学为了测定产品NaOH固体(含少量碳酸钠)中NaOH的质量分数,进行了如下实验:
Ⅰ.称取NaOH固体样品2.15g,加适量水使之完全溶解.
Ⅱ.向上述溶液中滴加CaCl2溶液至不再产生白色沉淀,过滤.
Ⅲ.向滤液中加入质量分数为10.0%的盐酸溶液,所加盐酸溶液的体积与溶液的pH关系如图2所示.
回答下列问题:
①图中a点溶液中所含的阴离子有___(填离子符号).
②如图3是氢氧化钠与盐酸反应示意图,该反应的本质可以表示为OH-+H+=H2O.步骤Ⅱ中反应的示意图如图4,则该反应的本质可以表示为:___.
③已知氯化钠、氯化钙溶液均呈中性.当所加入的盐酸溶液质量为18.25g时,溶液的pH=7,则NaOH固体样品中NaOH的质量分数是___.(写出计算过程,否则不得分.结果以百分比表示,保留3位有效数字)
▼优质解答
答案和解析
(1)碳酸钠俗称 纯碱,其主要用途有 制造玻璃、造纸、纺织和洗涤剂的生产等(写出一种即可).
(2)实验室进行溶解操作时,使用玻璃棒的主要目的是 加速溶解;操作a后面紧跟降温结晶,所以该过程应该是温度升高的浓缩过程,所以是 蒸发.
(3)“苛化”时主要发生两个化学反应,其一为:NaHCO3+Ca(OH)2═NaOH+CaCO3↓+H2O;由于“天然碱的主要成分是碳酸钠和碳酸氢钠“,第一个反应是与碳酸氢钠有关,则第二个反应与碳酸钠有关,碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,对应的化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓,该是两种化合物相互交换成分生成两种新的化合物,为复分解反应.
(4)某化学兴趣小组同学为了测定产品NaOH固体(含少量碳酸钠)中NaOH的质量分数,进行了如下实验:
Ⅰ.称取NaOH固体样品2.15g,加适量水使之完全溶解.
Ⅱ.向上述溶液中滴加CaCl2溶液至不再产生白色沉淀,过滤.
Ⅲ.向滤液中加入质量分数为10.0%的盐酸溶液,所加盐酸溶液的体积与溶液的pH关系如图2所示.
这个首先要清楚,先加入氯化钙使碳酸钠沉淀,之后用盐酸和氢氧化钠反应,所以后面给出的pH与盐酸的体积关系与碳酸钠无关,这一点对于分析问题①
尤为重要.
①图中表示的是向氢氧化钠和氯化钠的混合物溶液中加入盐酸,a点是溶液pH大于7,说明氢氧化钠还有剩余,所以此时的溶质有氢氧化钠和氯化钠,所以溶液中所含的阴离子有 Cl-和OH-.
②如图3是氢氧化钠与盐酸反应示意图,该反应的本质可以表示为OH-+H+=H2O.所谓本质结合图可以看出为实际过程中发生改变的微粒,所以步骤Ⅱ中反应的示意图如图4,前后减少的是钙离子和碳酸根离子,多的微粒是碳酸钙分子,所以该反应的本质可以表示为:Ca2++CO32-=CaCO3↓.
③已知氯化钠、氯化钙溶液均呈中性.当所加入的盐酸溶液质量为18.25g时,溶液的pH=7,由于盐酸的质量分数为10.0%.
设氢氧化钠的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 18.25g×10%
=
x=2g
则NaOH固体样品中NaOH的质量分数为
×100%≈93.0%
故答案为:
(1)纯碱; 制造玻璃、造纸、纺织和洗涤剂的生产等;
(2)加速溶解; 蒸发.
(3)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓; 复分解反应;
(4)
①Cl-和 OH-;
②Ca2++CO32-=CaCO3↓.
③93.0%
(1)碳酸钠俗称 纯碱,其主要用途有 制造玻璃、造纸、纺织和洗涤剂的生产等(写出一种即可).
(2)实验室进行溶解操作时,使用玻璃棒的主要目的是 加速溶解;操作a后面紧跟降温结晶,所以该过程应该是温度升高的浓缩过程,所以是 蒸发.
(3)“苛化”时主要发生两个化学反应,其一为:NaHCO3+Ca(OH)2═NaOH+CaCO3↓+H2O;由于“天然碱的主要成分是碳酸钠和碳酸氢钠“,第一个反应是与碳酸氢钠有关,则第二个反应与碳酸钠有关,碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,对应的化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓,该是两种化合物相互交换成分生成两种新的化合物,为复分解反应.
(4)某化学兴趣小组同学为了测定产品NaOH固体(含少量碳酸钠)中NaOH的质量分数,进行了如下实验:
Ⅰ.称取NaOH固体样品2.15g,加适量水使之完全溶解.
Ⅱ.向上述溶液中滴加CaCl2溶液至不再产生白色沉淀,过滤.
Ⅲ.向滤液中加入质量分数为10.0%的盐酸溶液,所加盐酸溶液的体积与溶液的pH关系如图2所示.
这个首先要清楚,先加入氯化钙使碳酸钠沉淀,之后用盐酸和氢氧化钠反应,所以后面给出的pH与盐酸的体积关系与碳酸钠无关,这一点对于分析问题①
尤为重要.
①图中表示的是向氢氧化钠和氯化钠的混合物溶液中加入盐酸,a点是溶液pH大于7,说明氢氧化钠还有剩余,所以此时的溶质有氢氧化钠和氯化钠,所以溶液中所含的阴离子有 Cl-和OH-.
②如图3是氢氧化钠与盐酸反应示意图,该反应的本质可以表示为OH-+H+=H2O.所谓本质结合图可以看出为实际过程中发生改变的微粒,所以步骤Ⅱ中反应的示意图如图4,前后减少的是钙离子和碳酸根离子,多的微粒是碳酸钙分子,所以该反应的本质可以表示为:Ca2++CO32-=CaCO3↓.
③已知氯化钠、氯化钙溶液均呈中性.当所加入的盐酸溶液质量为18.25g时,溶液的pH=7,由于盐酸的质量分数为10.0%.
设氢氧化钠的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 18.25g×10%
| 40 |
| 36.5 |
| x |
| 18.25g×10% |
x=2g
则NaOH固体样品中NaOH的质量分数为
| 2g |
| 2.15g |
故答案为:
(1)纯碱; 制造玻璃、造纸、纺织和洗涤剂的生产等;
(2)加速溶解; 蒸发.
(3)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓; 复分解反应;
(4)
①Cl-和 OH-;
②Ca2++CO32-=CaCO3↓.
③93.0%
看了天然碱的主要成分是碳酸钠和碳酸...的网友还看了以下:
求一套小学教学楼设计图要求:1、建筑面积3000平方米、2、6层、每层4个班、要有办公室、厕所3、 2020-04-06 …
五.按下面所给的材料写一张借条.六年级(3)班的余刚同学到图书室借一本《成语大词典》,活动课做准备 2020-05-13 …
怎样把下列名称译成英语:校长办公室,教导主任办公室,劳动器材室,体育器材室,少年儿童科学活动室,图 2020-05-13 …
学校图书室原有图书1400册,今年图书册数增加了12%现在图书室有多少册例式:140学校图书室原有 2020-05-13 …
作者从哪几个方面对陋室进行描写?(陋室铭)作者从哪几个方面对陋室进行描写的?突出陋室怎样的特征?是 2020-05-17 …
建筑制图问题总平面图的室外标高符号()、总平面图上的楼地面标高符号()、立面图()和剖面图的标高符 2020-08-01 …
学校图书室有科普读物300本,比故事书多13,图书室有故事书多少本?(先写出解决问题的数量关系,再解 2020-11-05 …
学校图书室有科普读物300本,比故事书多13,图书室有故事书多少本?(先写出解决问题的数量关系,再解 2020-11-21 …
学校图书室管理员要在图书室内景物的地方挂一个条幅,条幅上面写一句关于读书的名言.请你把自己认为合适的 2020-11-27 …
少先队活动室图书室阅览室音体美器材室二年级教室工会办公室音乐教室美术教室学前班教室一年级教室办公室求 2020-12-01 …