早教吧作业答案频道 -->化学-->
自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展.(1)分析下表数据可知:大气固氮反应属于(填“吸热”或“放热”)反应.2260℃时,向2L
题目详情
自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展.
(1)分析下表数据可知:大气固氮反应属于___(填“吸热”或“放热”)反应.2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是___(结果保留三位有效数字).
(2)工业固氮的主要形式是:N2 (g)+3H2 (g)⇌2NH3 (g)△H<0,如图是当反应器中按n(N2):n(H2)=1:3 投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
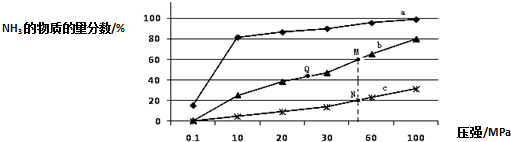
①曲线a对应的温度是___.
②关于工业合成氨的反应,下列叙述正确的是___(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=___(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是___,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是___.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为___.
(1)分析下表数据可知:大气固氮反应属于___(填“吸热”或“放热”)反应.2260℃时,向2L密闭容器中充入0.3molN2和0.3molO2,模拟大气固氮反应,达到平衡时,N2的转化率是___(结果保留三位有效数字).
| 反应 | 大气固氮N2(g)+O2(g)⇌2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |

①曲线a对应的温度是___.
②关于工业合成氨的反应,下列叙述正确的是___(填字母).
A.图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
B.工业合成氨之所以加入催化剂,是因为加入催化剂有利于提高反应的活化能
C.相同压强下,投料相同,达到平衡所需时间关系为c>b>a
③N点时c(NH3)=0.2mol/L,N点的化学平衡常数K=___(结果保留两位小数).
(3)合成氨原料气中的氢气可用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2mol CO2吸收316kJ热量,该反应的热化学方程式是___,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是___.
(4)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为___.
▼优质解答
答案和解析
(1)由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应;
2260℃时,向2L密闭容器中充入0.3mol N2和0.3mol O2,20s时反应达平衡,设此时得到NO为xmol,
N2(g)+O2(g)⇌2NO(g)
开始 0.3mol 0.3mol 0
转化
xmol
xmol xmol
平衡 (0.3-0.5x)mol (0.3-0.5x)mol xmol
化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数K=
=1,解得:x=0.2,
则平衡时消耗氮气的物质的量为:0.2mol×
=0.1mol,
所以平衡时氮气的转化率为:
×100%=33.3%,
故答案为:吸热;33.3%;
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200℃,
故答案为:200℃;
②A.平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故A正确;
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于降低反应的活化能,从而加快了反应速率,故B错误;
C.相同压强条件下,投料相同,温度越高反应速率越大,反应达到平衡时间越短,温度:a<b<c,则达到平衡所需时间关系为c<b<a,故C错误;
故答案为:A;
③N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)⇌2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
根据题意有:
=20%、2ab=0.2,联立解得:a=0.3,b=
,
所以平衡常数K=
=
≈0.93,
故答案为:0.93;
(3)CH4在高温、催化剂作用下与水蒸气反应的方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g),生成2mol CO2吸收316kJ热量,则1molCH4叁加反应时需要吸收的热量为158kJ,所以反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,CO2与K2CO3溶液反应生成碳酸氢钠钾,反应的离子方程式为CO32-+CO2+H2O=2HCO3-,
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol;CO32-+CO2+H2O=2HCO3-;
(4)利用电解法将NH3•H2O转化为对环境无污染的物质为氮气,阳极失去电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
2260℃时,向2L密闭容器中充入0.3mol N2和0.3mol O2,20s时反应达平衡,设此时得到NO为xmol,
N2(g)+O2(g)⇌2NO(g)
开始 0.3mol 0.3mol 0
转化
| 1 |
| 2 |
| 1 |
| 2 |
平衡 (0.3-0.5x)mol (0.3-0.5x)mol xmol
化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数K=
| x2 |
| (0.3-0.5x)2 |
则平衡时消耗氮气的物质的量为:0.2mol×
| 1 |
| 2 |
所以平衡时氮气的转化率为:
| 0.1mol |
| 0.3mol |
故答案为:吸热;33.3%;
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200℃,
故答案为:200℃;
②A.平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故A正确;
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于降低反应的活化能,从而加快了反应速率,故B错误;
C.相同压强条件下,投料相同,温度越高反应速率越大,反应达到平衡时间越短,温度:a<b<c,则达到平衡所需时间关系为c<b<a,故C错误;
故答案为:A;
③N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)⇌2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
根据题意有:
| 2ab |
| a-ab+3a-3ab+2ab |
| 1 |
| 3 |
所以平衡常数K=
| (2ab)2 |
| (a-ab)×(3a-3ab)3 |
| 25 |
| 27 |
故答案为:0.93;
(3)CH4在高温、催化剂作用下与水蒸气反应的方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g),生成2mol CO2吸收316kJ热量,则1molCH4叁加反应时需要吸收的热量为158kJ,所以反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,CO2与K2CO3溶液反应生成碳酸氢钠钾,反应的离子方程式为CO32-+CO2+H2O=2HCO3-,
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol;CO32-+CO2+H2O=2HCO3-;
(4)利用电解法将NH3•H2O转化为对环境无污染的物质为氮气,阳极失去电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
看了自从1902年德国化学家哈伯研...的网友还看了以下:
在自然环境良好的情况下的群落演替中,下列情况不可能发生的是()A.群落中物种组成不断变化B.开始时 2020-05-14 …
下列有关初生演替和次生演替的叙述,不正确的是()A.在群落演替过程中,群落的物种构成不断地发生着改 2020-05-14 …
对水循环重要意义的正确叙述是①使地表各圈层之间进行能量交换②使全球各地的降水量保持不变③使陆地径流 2020-05-16 …
下列事实,不能用勒夏特列原理解释的是()A.SO2催化氧化成SO3的反应,往往加入过量的空气B.合 2020-06-26 …
合成氨时,为什么不断将氨液化,移去液氨能提高合成氨的产率 2020-07-03 …
某同学观察了如图所示的实验后,得出以下结论,你认为其中不合理的是()A.氯化氢分子和氨分子是不断运 2020-07-22 …
在自然环境良好的情况下的群落演替中,下列情况不可能发生的是()A.群落中物种组成不断变化B.开始时的 2020-11-03 …
打开贮存氨水的容器,就可以闻到一股强烈的氨味.从微观角度分析,其原因是()A.氨分子在不断运动B.组 2020-11-06 …
下列关于群落演替的说法不正确的是()A.在群落演替过程中,群落的物种构成不断地发生着改变B.群落演替 2020-11-11 …
瑞典皇家科学院2009年10月6日宣布,华裔科学家、“光纤之父”高锟以及两名美国科学家获得2009年 2020-11-13 …