早教吧作业答案频道 -->化学-->
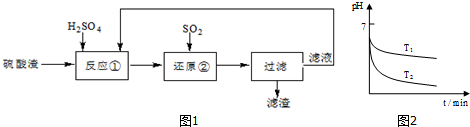
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程.如图1的流程中的滤液经过多次循环后用来后续制备氧化铁粉末.(1)为了加快反应①的反应速率,可采
题目详情
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程.如图1的流程中的滤液经过多次循环后用来后续制备氧化铁粉末.
(1)为了加快反应①的反应速率,可采用的措施是___.(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+.在温度T1、T2(T1>T2)
下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间
的变化曲线如图2所示.得出结论:该反应的温度不宜过高.
①通入SO2气体“还原”时,试解释pH下降的原因是___.
②相同时间内,T1温度下溶液的pH更高的原因是___.
(3)该流程中循环使用的物质是___.
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量.实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00mL.有关反应方程式如下:
2Fe3++2I-=2Fe2++I2; 2Na2S2O3+I2=Na2S4O6+2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程).

(1)为了加快反应①的反应速率,可采用的措施是___.(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+.在温度T1、T2(T1>T2)
下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间
的变化曲线如图2所示.得出结论:该反应的温度不宜过高.
①通入SO2气体“还原”时,试解释pH下降的原因是___.
②相同时间内,T1温度下溶液的pH更高的原因是___.
(3)该流程中循环使用的物质是___.
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量.实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00mL.有关反应方程式如下:
2Fe3++2I-=2Fe2++I2; 2Na2S2O3+I2=Na2S4O6+2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程).
▼优质解答
答案和解析
(1)结合影响反应速率的因素,固体在酸溶时,可通过固体粉碎、升高温度、搅拌、提高硫酸的浓度来提高反应速率,
故答案为:将硫酸渣粉碎、适当增大硫酸的浓度、升高温度、搅拌等;
(2)①Fe3+将SO2的水溶液(H2SO3)氧化为H2SO4,故溶液的pH会逐渐减少,也就是溶液的酸性增强,
故答案为:Fe3+将SO2的水溶液(H2SO3)氧化为H2SO4;
②温度升高,可以加快反应速率,但气体的溶解度却减小了,参加反应的SO2的量减少,故相同时间内,T1温度下溶液的pH更高,
故答案为:温度过高,SO2的溶解度下降;
(3)从流程图中可看出,可循环利用的物质是H2SO4,
故答案为:H2SO4;
(4)由反应式可得关系:Fe3+~Na2S2O3,n(Fe3+)=n(Na2S2O3)=20.00×10-3 L×0.50mol/L×10=0.1 mol,
∴c(Fe3+)=
=5.0mol/L,
答:原溶液铁离子浓度为5.0mol/L.
故答案为:将硫酸渣粉碎、适当增大硫酸的浓度、升高温度、搅拌等;
(2)①Fe3+将SO2的水溶液(H2SO3)氧化为H2SO4,故溶液的pH会逐渐减少,也就是溶液的酸性增强,
故答案为:Fe3+将SO2的水溶液(H2SO3)氧化为H2SO4;
②温度升高,可以加快反应速率,但气体的溶解度却减小了,参加反应的SO2的量减少,故相同时间内,T1温度下溶液的pH更高,
故答案为:温度过高,SO2的溶解度下降;
(3)从流程图中可看出,可循环利用的物质是H2SO4,
故答案为:H2SO4;
(4)由反应式可得关系:Fe3+~Na2S2O3,n(Fe3+)=n(Na2S2O3)=20.00×10-3 L×0.50mol/L×10=0.1 mol,
∴c(Fe3+)=
| 0.1mol |
| 20.00×10 -3L |
答:原溶液铁离子浓度为5.0mol/L.
看了 某科研人员设计出将硫酸渣(主...的网友还看了以下:
在8086/8088中,存储单元与I/O端口分别编址,指令MOV()A.既可以访问I/O端口,又可 2020-06-24 …
英语单词填空1.时间状语:d-r-n-2.场所:b-s-s-o-f-r--e-a-t-e-t3.教 2020-07-14 …
1.化简下列各式.(1)(-2-4i)-(-2+i)+(3+9i)(2)(1-i)^4(3)(3+ 2020-07-30 …
高二数学选修1---2计算1)(6-5i)+(3+2i);2)(2/3+i)+(1-2/3i)-(1 2020-10-30 …
英语翻译1、OldMacdonaldhadafarm.E-I-E-I-O.Andonthatfarm 2020-11-01 …
请教计算机组成原理问答题1.除了采用高速芯片外,分别指出存储器、运算器、控制器和I/O系统各自可采用 2020-11-03 …
在I/O设备、数据通道、时钟和软件这四项中,可能成为中断源的是。(A)I/O设备(B)I/O设备和数 2020-12-03 …
在I/O设备、数据通道、时钟和软件这四项中,可能成为中断源的是.(A)I/O设备(B)I/O设备和数 2020-12-03 …
大气中的部分碘源于O3对海水中Ⅰ-的氧化.将O3持续通入NaI溶液中进行模拟研究O3将I-氧化成I2 2020-12-04 …
S7-200系列的PLC的主机提供一定数量的数字量I/O和模拟量I/O,这些数字量I/O和模拟量I/ 2020-12-13 …