早教吧作业答案频道 -->化学-->
(1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是的,换句话说:化学反应的反应热只与体系的和有关,而与反应的无关(2)化学平
题目详情
(1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是___的,换句话说:化学反应的反应热只与体系的___和___有关,而与反应的___无关
(2)化学平衡两个本质特征是___、___
(3)已知:
2SO2(g)+O2 (g)⇌2SO3 (g)△H=-196.6kJ•mol-1
2NO(g)+O2 (g)⇌2NO2 (g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2 (g)⇌SO3 (g)+NO(g)△H=____kmJ•ol-1
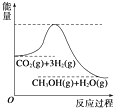
(4)目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),该反应的能量变化如图所示:则该反应的逆反应为___反应(填“吸热”或“放热”)上述反应平衡常数K的表达式为___,温度降低,平衡常数K___(填“增大”、“不变”或“减小”).
(2)化学平衡两个本质特征是___、___
(3)已知:
2SO2(g)+O2 (g)⇌2SO3 (g)△H=-196.6kJ•mol-1
2NO(g)+O2 (g)⇌2NO2 (g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2 (g)⇌SO3 (g)+NO(g)△H=____kmJ•ol-1
(4)目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),该反应的能量变化如图所示:则该反应的逆反应为___反应(填“吸热”或“放热”)上述反应平衡常数K的表达式为___,温度降低,平衡常数K___(填“增大”、“不变”或“减小”).

▼优质解答
答案和解析
(1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,即化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关,故答案为:相同;始态;终态;途径;
(2)化学平衡两个本质特征是反应物各组分的浓度保持不变和正反应速率等于逆反应速率不等于零,
故答案为:各组分的浓度保持不变;正反应速率等于逆反应速率不等于零;
(3)已知:①2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.
根据盖斯定律可知:将
可得:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=
=-41.8 kJ•mol-1
故答案为:-41.8;
(4)根据该反应的能量变化图,反应物总能量大于生成物总能量,所以则该反应为放热反应,则逆反应为吸热反应;平衡常数K的表达式K=
,因为反应为放热反应,则温度降低,平衡向正反应方向移动,则平衡常数K增大,故答案为:吸热; K=
;增大.
(2)化学平衡两个本质特征是反应物各组分的浓度保持不变和正反应速率等于逆反应速率不等于零,
故答案为:各组分的浓度保持不变;正反应速率等于逆反应速率不等于零;
(3)已知:①2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.
根据盖斯定律可知:将
| ①-② |
| 2 |
| -196.6+113 |
| 2 |
故答案为:-41.8;
(4)根据该反应的能量变化图,反应物总能量大于生成物总能量,所以则该反应为放热反应,则逆反应为吸热反应;平衡常数K的表达式K=
| c(CH 3OH)c(H 2O) |
| c(CO 2)c(H 2) 3 |
| c(CH 3OH)c(H 2O) |
| c(CO 2)c(H 2) 3 |
看了(1)盖斯定律的含义是:对于一...的网友还看了以下:
固定容积气体反应问题1密闭容器中冲入一定比例的气体反应,反应平衡后,转化率知道,求原始气体其中一种 2020-04-11 …
将1molA气体和1molB气体通入一体积不变的密闭容器中.在一定条件下发生如下发应:2A+B=2 2020-04-27 …
为什么气体的体积不变(在体积一定的密闭空间,气体的温度降低)不知是说的不准确,还是一定的,假如把温 2020-05-16 …
化学反应平衡的判定条件如 气体反应生成气体的反应 压强(密度等)一定那么平衡吗?aA(g)+bB( 2020-05-16 …
胶体本身是一种导体,当白酒酒体异常稳定的情况下,应有一稳定的电导率,因而测定酒体电导率,可知酒 2020-05-19 …
因为(),所以VB能够开发集声音、图像、动画等对象于一体的应用程序。 2020-05-31 …
各位是如何确定水热反应配体,反应温度,反应时间?各位探讨一下水热合成的一些问题吧,像如何确定水热反 2020-06-04 …
为什么固体表面积对平衡不影响假设一个反应在一定条件下平衡了,把反应物固体粉碎了,瞬间正反应速率不是 2020-06-04 …
在一固定容积的密闭容器中,充入2molX气体和1molY气体,发生反应:2X+Y==aW(全为气体 2020-06-05 …
对于反应前后气体的物质的量不变的纯气体反应,其平均相对分子质量总是不变.为什么条件一定要是气体?还 2020-06-21 …