早教吧作业答案频道 -->化学-->
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)已知:苯甲酸相对分子量122,熔点122.4℃,在25℃
题目详情
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
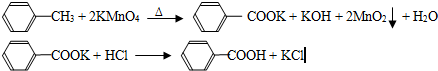
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示.
请回答:
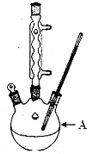
(1)装置A的名称___.若不用温度计,本实验控制反应温度的措施为___.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为___.
(3)操作②中趁热过滤的目的是___,操作I的名称___.
(4)步骤③中用到的定量仪器有分析天平,___,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为___.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将___(填“偏大”、“偏小”或“不变”).

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |

(1)装置A的名称___.若不用温度计,本实验控制反应温度的措施为___.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为___.
(3)操作②中趁热过滤的目的是___,操作I的名称___.
(4)步骤③中用到的定量仪器有分析天平,___,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为___.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将___(填“偏大”、“偏小”或“不变”).
▼优质解答
答案和解析
(1)由实验装置图可知A为三颈烧瓶;本实验控制反应温度约在100℃,可以采用水浴加热,而且要沸水加热,
故答案为:三颈烧瓶;沸水浴加热;
(2)实验使用了KMnO4做氧化剂,KMnO4中性条件下还原产物为MnO2,同时生成KOH,再加浓盐酸,除了生成苯甲酸,还有KCl和MnCl2生成,所以可能的无机杂质为为IKCl和MnCl2;
故答案为:MnCl2;
(3)苯甲酸在25℃和95℃时溶解度分别为0.3g和6.9g,操作②是要获得苯甲酸溶液,要尽量减小苯甲酸的损失,所以过滤时要趁热,防止苯甲酸结晶析出,减少其损失,将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,生成的苯甲酸溶解度较小,以晶体的形式析出,从混合液中得到沉淀一般采用过滤、干燥;
故答案为:防止苯甲酸结晶析出,减少其损失;过滤、干燥;
(4)托盘天平只能准确到0.1g,在步骤③中称取1.220g白色样品,所以需要精确度高的分析天平才能保证精确度;
故答案为:分析天平;
(5)第三次数据与其它数据差别较大舍去,平均消耗体积为
=24.00mL,则消耗的KOH的物质的量为0.1000mol/L×0.02400L=0.002400mol,苯甲酸(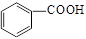 )中含有一个羧基,与氢氧化钾等物质的量恰好反应,则苯甲酸的物质的量为0.002400mol;
)中含有一个羧基,与氢氧化钾等物质的量恰好反应,则苯甲酸的物质的量为0.002400mol;
晶体中苯甲酸的总物质的量为0.002400mol×
=0.009600mol,
则样品中苯甲酸纯度为
×100%=96.00%;
故答案为:96.00%;
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视,两次度数距离偏小,即氢氧化钾的体积偏小,则消耗的氢氧化钾的物质的量偏小,求出的苯甲酸的物质的量偏小,所以苯甲酸的质量和质量分数也偏小;
故答案为:偏小.
故答案为:三颈烧瓶;沸水浴加热;
(2)实验使用了KMnO4做氧化剂,KMnO4中性条件下还原产物为MnO2,同时生成KOH,再加浓盐酸,除了生成苯甲酸,还有KCl和MnCl2生成,所以可能的无机杂质为为IKCl和MnCl2;
故答案为:MnCl2;
(3)苯甲酸在25℃和95℃时溶解度分别为0.3g和6.9g,操作②是要获得苯甲酸溶液,要尽量减小苯甲酸的损失,所以过滤时要趁热,防止苯甲酸结晶析出,减少其损失,将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,生成的苯甲酸溶解度较小,以晶体的形式析出,从混合液中得到沉淀一般采用过滤、干燥;
故答案为:防止苯甲酸结晶析出,减少其损失;过滤、干燥;
(4)托盘天平只能准确到0.1g,在步骤③中称取1.220g白色样品,所以需要精确度高的分析天平才能保证精确度;
故答案为:分析天平;
(5)第三次数据与其它数据差别较大舍去,平均消耗体积为
| 24.00+24.10+23.90 |
| 3 |
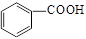 )中含有一个羧基,与氢氧化钾等物质的量恰好反应,则苯甲酸的物质的量为0.002400mol;
)中含有一个羧基,与氢氧化钾等物质的量恰好反应,则苯甲酸的物质的量为0.002400mol;晶体中苯甲酸的总物质的量为0.002400mol×
| 100ml |
| 25ml |
则样品中苯甲酸纯度为
| 0.009600mol×122g/mol |
| 1.220g |
故答案为:96.00%;
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视,两次度数距离偏小,即氢氧化钾的体积偏小,则消耗的氢氧化钾的物质的量偏小,求出的苯甲酸的物质的量偏小,所以苯甲酸的质量和质量分数也偏小;
故答案为:偏小.
看了苯甲酸广泛应用于制药和化工行业...的网友还看了以下:
某化工厂用废硫酸制备硫酸钾的流程如下:物质氯化钾硫酸钾氯化铵硫酸铵溶解度/g(20℃)34.211 2020-06-11 …
某化工厂用废硫酸制备硫酸钾的流程如下.物质氯化钾硫酸钾氯化铵硫酸铵溶解度/g(20℃)34.211 2020-06-11 …
含14N的脱氧核苷酸链数=(2^(n+1)-2条.设亲代DNA分子中含有某种脱氧核苷酸m个,则经过 2020-06-26 …
衣康酸M是制备高效除臭剂、粘合剂等多种精细化学品的重要原料,可经下列反应路线得到(部分反应条件略) 2020-06-27 …
化学-选修5:有机化学基础衣康酸M是化学合成工业的重要原料,可用于制备高效除臭剂、粘合剂等多种化学 2020-07-20 …
某有机物M()是一种重要的化工原料,请回答下列问题:(1)M的分子式为.M可由苯酚与氯乙烯在一定条件 2020-11-03 …
(2014•珠海二模)(1)图1为实验室制备、收集少量HCl的装置.①制备HCl所用药品为浓硫酸和浓 2020-11-12 …
高铁酸钾的确是一种新型、高效、多功能水处理剂,应用前景广阔.实验室以次氯酸盐和铁盐为原料制备少量高铁 2020-11-22 …
聚甲基丙烯酸羟乙酯的结构简式为,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:(1)由 2020-12-25 …
聚甲基丙烯酸羟乙酯的结构简式为,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式.(1)由 2020-12-25 …