早教吧作业答案频道 -->化学-->
新的研究表明二甲醚(DME)是符合中国能源结构特点的优良车用替代燃料,二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):①CH3OCH3(g)+H2O
题目详情
新的研究表明二甲醚(DME)是符合中国能源结构特点的优良车用替代燃料,二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g)+H2O(l)⇌2CH3OH(l)△H=+24.52kJ/mol
②CH3OH(l)+H2O(l)⇌CO2(g)+3H2(g)△H=+49.01kJ/mol
③CO(g)+H2O(l)⇌CO2(g)+H2(g)△H=-41.17kJ/mol
④CH3OH(l)⇌CO (g)+2H2(g)△H=+90.1kJ/mol
请回答下列问题:
(1)写出用二甲醚制H2同时全部转化为CO2时反应的热化学方程式___.
(2)200℃时反应③的平衡常数表达式K=___.
(3)在一常温恒容的密闭容器中,放入一定量的甲醇如④式建立平衡,以下可以作为该反应达到平衡状态的判断依据为___.
A.容器内气体密度保持不变 B.气体的平均相对分子质量保持不变
C.CO的体积分数保持不变 D.CO与H2的物质的量之比保持1:2不变
(4)工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如图1,2所示,
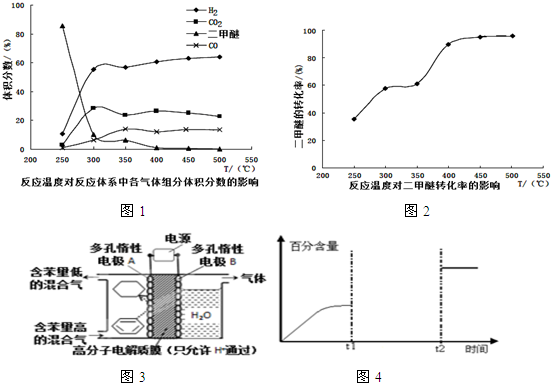
①你认为反应控制的最佳温度应为___.
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是(用相应的化学方程式表示)___.
(5)某一体积固定的密闭容器中进行反应②,200℃时达平衡;请在图4补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图象.
(6)一定条件下,如图3示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为___.
①CH3OCH3(g)+H2O(l)⇌2CH3OH(l)△H=+24.52kJ/mol
②CH3OH(l)+H2O(l)⇌CO2(g)+3H2(g)△H=+49.01kJ/mol
③CO(g)+H2O(l)⇌CO2(g)+H2(g)△H=-41.17kJ/mol
④CH3OH(l)⇌CO (g)+2H2(g)△H=+90.1kJ/mol
请回答下列问题:
(1)写出用二甲醚制H2同时全部转化为CO2时反应的热化学方程式___.
(2)200℃时反应③的平衡常数表达式K=___.
(3)在一常温恒容的密闭容器中,放入一定量的甲醇如④式建立平衡,以下可以作为该反应达到平衡状态的判断依据为___.
A.容器内气体密度保持不变 B.气体的平均相对分子质量保持不变
C.CO的体积分数保持不变 D.CO与H2的物质的量之比保持1:2不变
(4)工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如图1,2所示,

①你认为反应控制的最佳温度应为___.
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是(用相应的化学方程式表示)___.
(5)某一体积固定的密闭容器中进行反应②,200℃时达平衡;请在图4补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图象.
(6)一定条件下,如图3示装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为___.
▼优质解答
答案和解析
(1)①CH3OCH3(g)+H2O(l)⇌2CH3OH(l)△H=+24.5kJ/mol
②CH3OH(l)+H2O(l)⇌CO2(g)+3H2(g)△H=+49.01kJ/mol
由盖斯定律可知,①+②×2得:CH3OCH3(g)+3H2O(l)⇌2CO2(g)+6H2(g)△H=+24.5kJ/mol+49.01kJ/mol×2=+122.52KJ/mol,则热化学方程式为CH3OCH3(g)+3H2O(l)⇌2CO2(g)+6H2(g)△H=+122.52KJ/mol,
故答案为:CH3OCH3(g)+3H2O(l)⇌2CO2(g)+6H2(g)△H=+122.52KJ/mol;
(2)③200℃时CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.17kJ/mol,平衡常数表达式K=
,故答案为:
;
(3)A.在恒容容器中,体积不变,由CH3OH(l)⇌CO(g)+2H2(g)反应可得反应前后气体质量在变,所以密度保持不变,证明达到了化学平衡状态,故A正确;
B.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,则平均相对分子质量一直不变,所以平均相对分子质量保持不变不能证明达到了化学平衡状态,故B错误;
C.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,所以CO的体积分数一直不变,所以CO的体积分数保持不变,不能证明达到了化学平衡状态,故C错误;
D.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,所以不能证明达到了化学平衡状态,故D错误.
故答案为:A;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故答案为:C;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2⇌3H2+3CO,
故答案为:可能发生另一种制氢反应为CH3OCH3+CO2⇌3H2+3CO;
(5)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为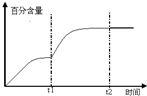 ,
,
故答案为: ;
;
(6)由图可知,左侧苯转化为环己烷,则左侧为阴极,阴极上苯得到电子,则阴极反应式为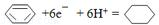 ,
,
故答案为: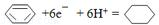 .
.
②CH3OH(l)+H2O(l)⇌CO2(g)+3H2(g)△H=+49.01kJ/mol
由盖斯定律可知,①+②×2得:CH3OCH3(g)+3H2O(l)⇌2CO2(g)+6H2(g)△H=+24.5kJ/mol+49.01kJ/mol×2=+122.52KJ/mol,则热化学方程式为CH3OCH3(g)+3H2O(l)⇌2CO2(g)+6H2(g)△H=+122.52KJ/mol,
故答案为:CH3OCH3(g)+3H2O(l)⇌2CO2(g)+6H2(g)△H=+122.52KJ/mol;
(2)③200℃时CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.17kJ/mol,平衡常数表达式K=
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
(3)A.在恒容容器中,体积不变,由CH3OH(l)⇌CO(g)+2H2(g)反应可得反应前后气体质量在变,所以密度保持不变,证明达到了化学平衡状态,故A正确;
B.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,则平均相对分子质量一直不变,所以平均相对分子质量保持不变不能证明达到了化学平衡状态,故B错误;
C.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,所以CO的体积分数一直不变,所以CO的体积分数保持不变,不能证明达到了化学平衡状态,故C错误;
D.由于甲醇为液体,气体的组成一直不变,CO与氢气的物质的量之比一直是1:2,所以不能证明达到了化学平衡状态,故D错误.
故答案为:A;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故答案为:C;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2⇌3H2+3CO,
故答案为:可能发生另一种制氢反应为CH3OCH3+CO2⇌3H2+3CO;
(5)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为
 ,
,故答案为:
 ;
;(6)由图可知,左侧苯转化为环己烷,则左侧为阴极,阴极上苯得到电子,则阴极反应式为
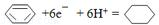 ,
,故答案为:
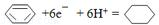 .
.
看了新的研究表明二甲醚(DME)是...的网友还看了以下:
30分!求两道关于预备年纪一元一次方程的应用题分不是乱拿的哦:1.用方程解2.(1)若银行一年定期储 2020-03-30 …
解X的一元二次方程的应用题中的M已知方程X^2+2X+M=0两个根的差的平方是16,利用公式法求M 2020-04-26 …
问道微分方程的应用题!已知在一定条件下可认为,伞兵降落过程中所受阻力与当时下降的速率成正比.一个伞 2020-05-17 …
一些对大学生感到很容易的数学题!我一定会在1小时之内采纳你哦!初一一元一次方程的应用1.1.根据下 2020-05-21 …
MicrosoftWord停止了对鼠标和键盘敲击的响应,您决定使用TaskManager(任务管理器 2020-05-31 …
一元二次方程的应用:某化工材料经销公司购进了一种化工原料共7000kg,购进价格为每千克30元.物 2020-06-03 …
二元一次方程组与应用题不会列怎么办?马上月考了,可是二元一次方程的应用题不会列方程怎么办? 2020-06-10 …
初二数学分式方程的应用(可以直接写出等量关系,有一工程队需在规定日期内完成,如果甲单独工作,刚好按 2020-06-10 …
基因工程的应用:利用转基因技术,可以定向地改良作物和家畜品种.例如,;生产某些药物,如等. 2020-06-18 …
一元一次方程的应用某部队一次行军训练,限定7小时完成任务,训练过程中休息共用去30分钟,去时的速度 2020-06-27 …