早教吧作业答案频道 -->化学-->
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2,过氧化钙可用于改善水质、处
题目详情
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2,过氧化钙可用于改善水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等,是一种重要化工试剂.
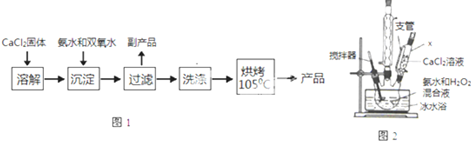
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)仪器x的名称为___
(2)用平衡移动原理解释加入氨水的作用是___.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是___、___(写出两种)
(4)过滤后洗涤沉淀的试剂最好用___
A.热水 B.冷水 C.乙醇 D.乙醚
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度___
(6)测得CaO2纯度偏低的原因可能是___
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.

(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)仪器x的名称为___
(2)用平衡移动原理解释加入氨水的作用是___.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是___、___(写出两种)
(4)过滤后洗涤沉淀的试剂最好用___
A.热水 B.冷水 C.乙醇 D.乙醚
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度___
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.
▼优质解答
答案和解析
(Ⅰ)(1)图2中仪器X为恒压滴液漏斗(或恒压分液漏斗,起到冷凝作用,
故答案为:恒压滴液漏斗(或恒压分液漏斗);
(2)氯化钙与双氧水的反应方程式为:CaCl2+H2O2⇌CaO2+2HCl,加入氨水可以与氯化氢发生中和反应,使该可逆反应向着生成过氧化钙的方向移动,提高的过氧化钙的产率,
故答案为:中和反应生成的HCl,使CaCl2+H2O2⇌CaO2+2HCl向右进行;
(3)由于温度较高时双氧水容易分解,会导致过氧化钙产率下降,且温度降低时过氧化钙的溶解度减小,有利于过氧化钙的析出,所以沉淀反应时常用冰水浴控制温度在0℃左右,
故答案为:减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热);
(4)A.热水:过氧化钙在热水中溶解度较大,降低了过氧化钙的产率,故A错误;
B.冷水:过氧化钙极微溶于水,且杂质都易溶于水,可用冷水洗涤过氧化钙,故B正确;
C.乙醇:过氧化钙不溶于乙醇,但是杂质不溶于乙醇,且提高了成本,故C错误;
D.乙醚:过氧化钙不溶于乙醚,但杂质也不溶于乙醚,且乙醚成本较高,故D错误;
故答案为:B;
(Ⅱ)、(5)根据表中消耗高锰酸钾溶液的体积数据可知,第三次数据与其它三组误差较大,应该舍弃;则滴定中消耗酸性高锰酸钾的平均体积为:
mL=20.00mL,每次滴定消耗的高锰酸钾的物质的量为:n(KMnO4)=0.1000mol/L×0.02L=0.002mol,
KMnO4反应后生成Mn2+,化合价降低7-2)=5价,CaO2被氧化成氧气,化合价从-1升高到0价,至少升高:[0-(-1)]×2=2,根据化合价升降相等可得反应的关系式:2KMnO4~5CaO2,则每次称取0.4000g样品中含有的过氧化钙的物质的量为:n(CaO2)=
×n(KMnO4)=0.002mol×
=0.005mol,
所以该样品中过氧化钙的纯度为:
×100%=90.00%,
故答案为:90.00%;
(6)A.烘烤时间不足,样品中含有杂质水分,导致样品中过氧化钙的纯度偏小,故A正确;
B.在洁净干燥的酸式滴定管中未润洗即装标准液,标准液被蒸馏水稀释,滴定时消耗的标准液体积偏大,计算出的过氧化钙的纯度偏大,故B错误;
C.滴定前尖嘴处有气泡,滴定后消失,导致消耗的标准液体积偏大,根据关系式计算出的过氧化钙的质量偏大,过氧化钙的纯度偏高,故C错误;
D.配制KMnO4标准溶液定容时俯视容量瓶标线,导致标准液浓度偏高,滴定过程中营养样品中过氧化钙的物质的量不变,则消耗的标准液体积偏小,测定的过氧化钙的纯度偏小,故D正确;
故答案为:AD.
故答案为:恒压滴液漏斗(或恒压分液漏斗);
(2)氯化钙与双氧水的反应方程式为:CaCl2+H2O2⇌CaO2+2HCl,加入氨水可以与氯化氢发生中和反应,使该可逆反应向着生成过氧化钙的方向移动,提高的过氧化钙的产率,
故答案为:中和反应生成的HCl,使CaCl2+H2O2⇌CaO2+2HCl向右进行;
(3)由于温度较高时双氧水容易分解,会导致过氧化钙产率下降,且温度降低时过氧化钙的溶解度减小,有利于过氧化钙的析出,所以沉淀反应时常用冰水浴控制温度在0℃左右,
故答案为:减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热);
(4)A.热水:过氧化钙在热水中溶解度较大,降低了过氧化钙的产率,故A错误;
B.冷水:过氧化钙极微溶于水,且杂质都易溶于水,可用冷水洗涤过氧化钙,故B正确;
C.乙醇:过氧化钙不溶于乙醇,但是杂质不溶于乙醇,且提高了成本,故C错误;
D.乙醚:过氧化钙不溶于乙醚,但杂质也不溶于乙醚,且乙醚成本较高,故D错误;
故答案为:B;
(Ⅱ)、(5)根据表中消耗高锰酸钾溶液的体积数据可知,第三次数据与其它三组误差较大,应该舍弃;则滴定中消耗酸性高锰酸钾的平均体积为:
| 19.98+20.02+20.00 |
| 3 |
KMnO4反应后生成Mn2+,化合价降低7-2)=5价,CaO2被氧化成氧气,化合价从-1升高到0价,至少升高:[0-(-1)]×2=2,根据化合价升降相等可得反应的关系式:2KMnO4~5CaO2,则每次称取0.4000g样品中含有的过氧化钙的物质的量为:n(CaO2)=
| 5 |
| 2 |
| 5 |
| 2 |
所以该样品中过氧化钙的纯度为:
| 0.005mol×72g/mol |
| 0.4000g |
故答案为:90.00%;
(6)A.烘烤时间不足,样品中含有杂质水分,导致样品中过氧化钙的纯度偏小,故A正确;
B.在洁净干燥的酸式滴定管中未润洗即装标准液,标准液被蒸馏水稀释,滴定时消耗的标准液体积偏大,计算出的过氧化钙的纯度偏大,故B错误;
C.滴定前尖嘴处有气泡,滴定后消失,导致消耗的标准液体积偏大,根据关系式计算出的过氧化钙的质量偏大,过氧化钙的纯度偏高,故C错误;
D.配制KMnO4标准溶液定容时俯视容量瓶标线,导致标准液浓度偏高,滴定过程中营养样品中过氧化钙的物质的量不变,则消耗的标准液体积偏小,测定的过氧化钙的纯度偏小,故D正确;
故答案为:AD.
看了过氧化钙(CaO2)是一种白色...的网友还看了以下:
图为肺泡与毛细血管之间的气体交换示意图,下列说法正确的是()A.a,b分别代表的物质是氧气和二氧化 2020-04-07 …
(1)甲图是一种“化学氧自救器”,主要用于煤矿井下应急.它利用人呼出的二氧化碳与自救器药罐中的生氧 2020-04-08 …
如图图示中,A图是一种“化学氧自救器”,主要用于煤矿进下应急和机体缺氧病人的自救,它利用人呼出的二 2020-04-08 …
下列图示中,A图是一种“化学氧自救器”,主要用于煤矿进下应急和机体缺氧病人的自救,它利用人呼出的二 2020-04-08 …
下列对化学知识概括合理的是()A.酸性氧化物都是非金属氧化物B.一种元素可能有多种氧化物,但同种化 2020-05-02 …
下列对化学知识概括合理的是()A.酸性氧化物都是非金属氧化物B.一种元素可能有多种氧化物,但同种化 2020-05-02 …
钝化反应是氧化还原反应吗钝化是氧化还原反应吗 2020-05-17 …
按要求写化学方程式在线等一种单质还原一种化合物的一种元素一种单质氧化一种化合物的一种元素同一种物质 2020-06-04 …
重铬酸根与铬酸根的转化是氧化还原反应吗薛金星编的教材全解上说是,因此发生了电子的转移.但我搞不明白 2020-06-05 …
关于铁氧化后的晶型问题三氧化二铁有两种晶型,一种是γ氧化铁,另一种是α氧化铁.铁氧在常温下氧化后, 2020-06-26 …