早教吧作业答案频道 -->化学-->
氢气是一种高能燃料,也广范应用在工业合成中.(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1mol化合物的焓变.已知25℃和101kPa时下列反应:①2C2H6(g)+7O2(g)═4CO2(g)+6
题目详情
氢气是一种高能燃料,也广范应用在工业合成中.
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1mol化合物的焓变.已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3116kJ•mol-1
②C(石墨,s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
③2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ•mol-1
写出乙烷标准生成焓的热化学方程式:___.
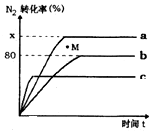
(2)已知合成氨的反应为:N2+3H2⇌2NH3△H<0.某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
①图中代表反应在恒容绝热容器中进行的曲线是___(用a、b、c表示).
②曲线a条件下该反应的平衡常数K=___.
③b容器中M点,v(正)___ v(逆)(填“大于”、“小于”.或“等于”).
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2.阴极电极反应式为___;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为___.
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径.
已知:Cu(OH)2(s)⇌Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3•H2O⇌[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3•H2O⇌[Cu(NH3)4]2++4H2O+2OH-配制铜氨溶液是否可行:___.
②已知反应Cu(OH)2(s)+2NH3•H2O+2NH4+⇌[Cu(NH3)4]2++4H2O K=5.16×102.向盛有少量Cu(OH)2固体的试管中加入14mol/L的氨水,得到悬浊液;此时若加入适量的硫酸按固体,出现的现象为___;解释出现该现象的原因是___.

(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1mol化合物的焓变.已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3116kJ•mol-1
②C(石墨,s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
③2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ•mol-1
写出乙烷标准生成焓的热化学方程式:___.
(2)已知合成氨的反应为:N2+3H2⇌2NH3△H<0.某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
①图中代表反应在恒容绝热容器中进行的曲线是___(用a、b、c表示).
②曲线a条件下该反应的平衡常数K=___.
③b容器中M点,v(正)___ v(逆)(填“大于”、“小于”.或“等于”).
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2.阴极电极反应式为___;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为___.
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径.
已知:Cu(OH)2(s)⇌Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3•H2O⇌[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3•H2O⇌[Cu(NH3)4]2++4H2O+2OH-配制铜氨溶液是否可行:___.
②已知反应Cu(OH)2(s)+2NH3•H2O+2NH4+⇌[Cu(NH3)4]2++4H2O K=5.16×102.向盛有少量Cu(OH)2固体的试管中加入14mol/L的氨水,得到悬浊液;此时若加入适量的硫酸按固体,出现的现象为___;解释出现该现象的原因是___.
▼优质解答
答案和解析
(1)①2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3116kJ•mol-1;②C(石墨,s+O2(g)=CO2(g)△H=-393.5kJ•mol-1;③2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ•mol-1;根据盖斯定律可知:△H=-
+2②+
③,即乙烷标准生成焓的热化学方程式:2C(石墨)+3H2(g)=C2H6(g)△H=-86.4kJ/mol,故答案为:2C(石墨)+3H2(g)=C2H6(g)△H=-86.4kJ/mol;
(2)①N2+3H2⇌2NH3△H<0,而恒容绝热容器中进行,所以体系温度最高,反应速率最快,达平衡的时间最短,而由图可知消耗时间最短的是c,故选:c;
②平衡常数是温度的函数,温度不变K不变,而曲线a和曲线b的温度相同,
N2 +3H2 ⇌2NH3,
初起:1mol 2.8mol 0
变化:0.8mol 2.4mol 1.6mol
平衡:0.2mol 0.4mol 1.6mol
所以Kb=
=800=Ka,故答案为:800;
③b容器中M点,最终达平衡状态,所以氮气的转化率减小,平衡逆向移动,则v(正)小于v(逆),故答案为:小于;
(3)阴极发生还原反应,电极反应式为2NO2-+6e-+4H2O=N2↑+8OH-;阴极收集到1l.2LN2时,即物质的量为0.5mol,转移电子数的物质的量为:3mol,所以消耗氨气的物质的量为:1mol,则标况下的体积为22.4L,
故答案为:2NO2-+6e-+4H2O=N2↑+8OH-;22.4L;
(4)①K<10-5化学反应不发生,再根据①Cu(OH)2(s)⇌Cu2++2OH- Ksp=2.2×10-20、②Cu2++4NH3•H2O⇌[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012,由①+②得到Cu(OH)2(s)+4NH3•H2O⇌[Cu(NH3)4]2++4H2O+2OH-,所以该反应的K=Ksp•Kβ=1.6×10-7<10-5,所以反应很难进行,
故答案为:该反应的K=Ksp•Kβ=1.6×10-7<10-5,所以反应很难进行;
②氢氧化四氨合铜是强碱,加硫酸使Cu(OH)2(s)+2NH3•H2O+2NH4+⇌[Cu(NH3)4]2++4H2O平衡正向移动,而络离子要稳定存在必须在碱性条件下,所以观察络离子溶解,得到深蓝色的溶液,
故答案为:固体溶解,得到深蓝色溶液;溶液中存在平衡Cu(OH)2(s)+2NH3•H2O+2NH4+⇌[Cu(NH3)4]2++4H2O,加入硫酸按固体增大了按根离子浓度,平衡正向移动.
| ① |
| 2 |
| 3 |
| 2 |
(2)①N2+3H2⇌2NH3△H<0,而恒容绝热容器中进行,所以体系温度最高,反应速率最快,达平衡的时间最短,而由图可知消耗时间最短的是c,故选:c;
②平衡常数是温度的函数,温度不变K不变,而曲线a和曲线b的温度相同,
N2 +3H2 ⇌2NH3,
初起:1mol 2.8mol 0
变化:0.8mol 2.4mol 1.6mol
平衡:0.2mol 0.4mol 1.6mol
所以Kb=
| 0.82 |
| 0.23×0.1 |
③b容器中M点,最终达平衡状态,所以氮气的转化率减小,平衡逆向移动,则v(正)小于v(逆),故答案为:小于;
(3)阴极发生还原反应,电极反应式为2NO2-+6e-+4H2O=N2↑+8OH-;阴极收集到1l.2LN2时,即物质的量为0.5mol,转移电子数的物质的量为:3mol,所以消耗氨气的物质的量为:1mol,则标况下的体积为22.4L,
故答案为:2NO2-+6e-+4H2O=N2↑+8OH-;22.4L;
(4)①K<10-5化学反应不发生,再根据①Cu(OH)2(s)⇌Cu2++2OH- Ksp=2.2×10-20、②Cu2++4NH3•H2O⇌[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012,由①+②得到Cu(OH)2(s)+4NH3•H2O⇌[Cu(NH3)4]2++4H2O+2OH-,所以该反应的K=Ksp•Kβ=1.6×10-7<10-5,所以反应很难进行,
故答案为:该反应的K=Ksp•Kβ=1.6×10-7<10-5,所以反应很难进行;
②氢氧化四氨合铜是强碱,加硫酸使Cu(OH)2(s)+2NH3•H2O+2NH4+⇌[Cu(NH3)4]2++4H2O平衡正向移动,而络离子要稳定存在必须在碱性条件下,所以观察络离子溶解,得到深蓝色的溶液,
故答案为:固体溶解,得到深蓝色溶液;溶液中存在平衡Cu(OH)2(s)+2NH3•H2O+2NH4+⇌[Cu(NH3)4]2++4H2O,加入硫酸按固体增大了按根离子浓度,平衡正向移动.
看了氢气是一种高能燃料,也广范应用...的网友还看了以下:
下列说法正确的是()A.反应焓变是指1g物质参加反应时的能量变化B.当反应放热时,△H>0,反应吸 2020-04-11 …
为什么同底数幂中被除数指数非要大于除数指数?即a的m次方/a的n次方(m,n是正整数,a不等于零, 2020-05-13 …
在线求指导:对反应方向起决定作用对反应方向起决定作用的因素的判断不正确的是[]A.有时焓变对反应方 2020-05-17 …
下列各分式中,取值可能为0的是?A.(m的平方+1)÷(m的平方-1)B.(m的平方-1)÷(m+ 2020-07-18 …
下列结论正确的是()A.幂的乘方,指数不变,底数相乘B.幂的乘方,底数不变,指数相加C.a的m次幂 2020-07-30 …
分数指数运算里为什么规定a^(m/n)=n√(a^m)中m/n必须是最简比书上是这么写的但我觉得这 2020-07-30 …
1)变量的指针,其含义是指该变量的.A.值B.地址C.名D.一个标志2)若需要建立如图所示的存储结 2020-07-30 …
下列结论正确的是()A.幂的乘方,指数不变,底数相乘B.幂的乘方,底数不变,指数相加C.a的m次幂 2020-08-01 …
下列说法正确的是()A.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的 2020-11-02 …
如图的程序框图(未完成).设当箭头a指向①时,输出的结果s=m,当箭头a指向②时,输出的结果s=n, 2020-11-27 …