早教吧作业答案频道 -->化学-->
炼锌厂产生的工业废渣-锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4•7H2O和金属镉是一个有益的尝试,其流程如下:已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化
题目详情
炼锌厂产生的工业废渣-锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4•7H2O和金属镉是一个有益的尝试,其流程如下:
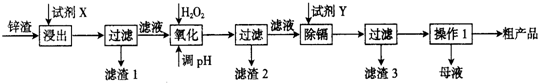
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强.
试回答下列问题:
(1)“浸出”时用到的“试剂X”为___(填名称).
(2)写出“氧化”过程的离子方程式___.
(3)“调pH”过程可以选用___.(从以下选项选择,填序号)
A.H2SO4 B.ZnO C.NaOH D.ZnCO3
“滤渣2”的主要成分是___(填化学式,下同).
(4)“试剂Y”是___;写出除去Cd2+的化学方程式___.
(5)“操作1”的方法是___;在“操作1”时,必须采取的实验措施是___.

已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强.
试回答下列问题:
(1)“浸出”时用到的“试剂X”为___(填名称).
(2)写出“氧化”过程的离子方程式___.
(3)“调pH”过程可以选用___.(从以下选项选择,填序号)
A.H2SO4 B.ZnO C.NaOH D.ZnCO3
“滤渣2”的主要成分是___(填化学式,下同).
(4)“试剂Y”是___;写出除去Cd2+的化学方程式___.
(5)“操作1”的方法是___;在“操作1”时,必须采取的实验措施是___.
▼优质解答
答案和解析
(1)Zn、Fe、Al、Cd、SiO2中,只有二氧化硅不能和硫酸反应,可以用硫酸将之溶解,过滤,先获得二氧化硅,
故答案为:硫酸溶液;
(2)为了将杂质离子铝离子以及三价铁离子沉淀下来,结合离子沉淀的条件,首先要将亚铁离子氧化为三价铁离子,然后再将之形成沉淀,反应实质是:2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:2H++H2O2+2Fe2+=2Fe3++2H2O;
(3)“调pH”过程能使得溶液的碱性增强,同时不能引入杂质离子,据此能选择试剂氧化锌、碳酸锌,该试剂可以将三价铁和铝离子沉淀下来,形成Fe(OH)3、Al(OH)3,
故答案为:BD;Fe(OH)3、Al(OH)3;
(4)金属Cd的活泼性比金属锌差,可以用金属锌能来置换金属铬,为将金属铬全部置换往往加入过量的金属锌,所以“试剂Y”是金属锌,“滤渣3”的成分为剩余的金属锌和置换出的金属铬,除去Cd2+的化学方程式为:Zn+CdSO4=ZnSO4+Cd,
故答案为:Zn;Zn+CdSO4=ZnSO4+Cd;
(5)从硫酸锌溶液中获得纯净的硫酸锌的晶体的方法是加热浓缩、蒸发结晶、过滤洗涤,但是要注意保持溶液一定的酸度,防止金属阳离子的水解,
故答案为:蒸发浓缩、蒸发结晶、过滤洗涤;保持溶液一定的酸度.
故答案为:硫酸溶液;
(2)为了将杂质离子铝离子以及三价铁离子沉淀下来,结合离子沉淀的条件,首先要将亚铁离子氧化为三价铁离子,然后再将之形成沉淀,反应实质是:2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:2H++H2O2+2Fe2+=2Fe3++2H2O;
(3)“调pH”过程能使得溶液的碱性增强,同时不能引入杂质离子,据此能选择试剂氧化锌、碳酸锌,该试剂可以将三价铁和铝离子沉淀下来,形成Fe(OH)3、Al(OH)3,
故答案为:BD;Fe(OH)3、Al(OH)3;
(4)金属Cd的活泼性比金属锌差,可以用金属锌能来置换金属铬,为将金属铬全部置换往往加入过量的金属锌,所以“试剂Y”是金属锌,“滤渣3”的成分为剩余的金属锌和置换出的金属铬,除去Cd2+的化学方程式为:Zn+CdSO4=ZnSO4+Cd,
故答案为:Zn;Zn+CdSO4=ZnSO4+Cd;
(5)从硫酸锌溶液中获得纯净的硫酸锌的晶体的方法是加热浓缩、蒸发结晶、过滤洗涤,但是要注意保持溶液一定的酸度,防止金属阳离子的水解,
故答案为:蒸发浓缩、蒸发结晶、过滤洗涤;保持溶液一定的酸度.
看了炼锌厂产生的工业废渣-锌渣(除...的网友还看了以下:
六、作者在《清代学术概论》中说:“启超夙不喜桐城派古文,幼年为文,学晚汉、魏、晋,颇尚矜炼,至是自 2020-06-12 …
六、作者在《清代学术概论》中说:“启超夙不喜桐城派古文,幼年为文,学晚汉、魏、晋,颇尚矜炼,至是自 2020-06-12 …
①立捶杀数人,尽斥属僚之贪虐庸懦者②钟乃蠲烦苛,立条教,事不便民者,立上书言之③凡忱所行善政,钟皆 2020-06-16 …
塞外杂咏林则徐诗人运用哪些手法来写天山?请结合具体诗句加以分析天山万笏耸琼瑶①,导我西行伴寂寥②. 2020-06-19 …
根据课文:六、作者在《清代学术概论》中说:“启超夙不喜桐城派古文,幼年为文,学晚汉、魏、晋,颇尚矜 2020-06-29 …
10.在南宋临安,街头吆喝,小贩叫卖,勾栏表演,汴京话声声入耳。杭州杂剧,以中原音韵为主,杂以杭州 2020-07-02 …
请替彬彬设计一段话回答爸爸,要说服爸爸同意彬彬在课余时间读课外书,以消除父子间的误会.情境:彬彬正在 2020-11-03 …
一道个人所得税经典案例,帮帮忙啊!某高校老师,2006年5月取得收入如下:(1)工资2000元,奖金 2020-11-25 …
杂交育种方法除了获得新品种之外,杂交的另一个结果是获得() 2021-01-02 …
英语翻译1在课堂上认真听讲,记笔记,而且还要积极主动2课后认真复习,记单词,和惯用法,和同学多用英语 2021-02-05 …