早教吧作业答案频道 -->化学-->
氢能被视为21世纪最具发展潜力的清洁能源.(1)水制取H2的常见原料,下列有关水的说法正确的是a.水分子是一种极性分子,水分子空间结构呈直线型b.H2O分子中有2个由s轨道与sp3杂化
题目详情
氢能被视为21世纪最具发展潜力的清洁能源.
(1)水制取H2的常见原料,下列有关水的说法正确的是___
a.水分子是一种极性分子,水分子空间结构呈直线型
b.H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
c.水分子间通过H-O键形成冰晶体
d.冰晶胞中水分子的空间排列方式与干冰晶胞类似
(2)氢气的安全贮存和运输是氢能应用的关键.
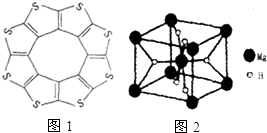
①最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(如图1所示),每个平面上下两侧最多可存10个H2分子.分子中C原子的杂化轨道类型为___,C16S8中碳硫键键长介于C-S与C=S之间,原因可能是___,C16S8与H2微粒间的作用力是___
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(.用“→”表示)的氨硼烷的结构式___;与氨硼烷互为等电子体的有机小分子是___(写结构简式).
③一种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进人到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构相似,该晶体储氢后的化学式为___.
④MgH2是金属氢化物储氢材料,其晶胞如图2所示,已知该晶体的密度ag٠cm-3,则晶胞的体积为___cm3〔用含a,、NA的代数式表示,NA表示阿伏伽德罗常数〕.

(1)水制取H2的常见原料,下列有关水的说法正确的是___
a.水分子是一种极性分子,水分子空间结构呈直线型
b.H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
c.水分子间通过H-O键形成冰晶体
d.冰晶胞中水分子的空间排列方式与干冰晶胞类似
(2)氢气的安全贮存和运输是氢能应用的关键.
①最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(如图1所示),每个平面上下两侧最多可存10个H2分子.分子中C原子的杂化轨道类型为___,C16S8中碳硫键键长介于C-S与C=S之间,原因可能是___,C16S8与H2微粒间的作用力是___
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(.用“→”表示)的氨硼烷的结构式___;与氨硼烷互为等电子体的有机小分子是___(写结构简式).
③一种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进人到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构相似,该晶体储氢后的化学式为___.
④MgH2是金属氢化物储氢材料,其晶胞如图2所示,已知该晶体的密度ag٠cm-3,则晶胞的体积为___cm3〔用含a,、NA的代数式表示,NA表示阿伏伽德罗常数〕.
▼优质解答
答案和解析
(1)a.H2O分子空间结构呈V型,正负电荷中心不重合,属于极性分子,故a错误;
b.H2O分子中2个氢原子的2个由s轨道与氧原子的sp3杂化轨道形成σ键,故b正确;
c.水形成冰晶体是通过氢键作用的,不是H-O键,故c错误;
d.冰晶胞: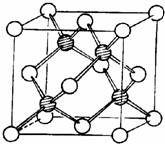 ,干冰晶胞:
,干冰晶胞: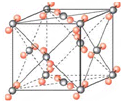 ,即冰晶胞中水分子的空间排列方式与干冰胞不同,故d错误;
,即冰晶胞中水分子的空间排列方式与干冰胞不同,故d错误;
故答案为:b;
(2)①根据图2结构可知:碳原子形成2个C-S,1个C=S二键,C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式;
分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质,可导致C16S8中碳硫键键长介于C-S与C=S之间;
分子之间存在范德华力,C16S8与H2微粒间的作用力是范德华力,
故答案为:sp2;分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质;范德华力;
②氮原子提供一对共用电子对给硼原子形成配位键,氨硼烷的结构式为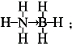 ,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,
,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,
故答案为: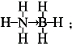 ;CH3CH3;
;CH3CH3;
③CaF2的结构如图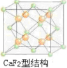 ,根据题意知,该晶胞中铜原子个数=6×
,根据题意知,该晶胞中铜原子个数=6×
=3,金原子个数=8×
=1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,
故答案为:Cu3AuH8;
④该晶胞中镁原子个数=
×8+1=2,氢原子个数=4×
+2=4,V=
=
cm3=
cm3,
故答案为:
.
b.H2O分子中2个氢原子的2个由s轨道与氧原子的sp3杂化轨道形成σ键,故b正确;
c.水形成冰晶体是通过氢键作用的,不是H-O键,故c错误;
d.冰晶胞:
 ,干冰晶胞:
,干冰晶胞: ,即冰晶胞中水分子的空间排列方式与干冰胞不同,故d错误;
,即冰晶胞中水分子的空间排列方式与干冰胞不同,故d错误;故答案为:b;
(2)①根据图2结构可知:碳原子形成2个C-S,1个C=S二键,C原子杂化轨道数为(2+1)=3,C原子采取sp2杂化方式;
分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质,可导致C16S8中碳硫键键长介于C-S与C=S之间;
分子之间存在范德华力,C16S8与H2微粒间的作用力是范德华力,
故答案为:sp2;分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质;范德华力;
②氮原子提供一对共用电子对给硼原子形成配位键,氨硼烷的结构式为
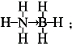 ,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,
,等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,故答案为:
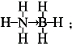 ;CH3CH3;
;CH3CH3;③CaF2的结构如图
 ,根据题意知,该晶胞中铜原子个数=6×
,根据题意知,该晶胞中铜原子个数=6×| 1 |
| 2 |
| 1 |
| 8 |
故答案为:Cu3AuH8;
④该晶胞中镁原子个数=
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| ρ |
| ||
| ρ |
| 52 |
| a•NA |
故答案为:
| 52 |
| a•NA |
看了氢能被视为21世纪最具发展潜力...的网友还看了以下:
高二直线方程问题1.求过点A(-1,1),且与点B(2,5)的距离最大的直线l的点法向式方程2.已知 2020-03-30 …
CO2分子是直线型,其C原子的成键轨道是A2个sp杂化轨道B2个p轨道C2个sp杂化轨道及2个p轨 2020-04-26 …
氯气Cl2轨道Cl2的两个氯原子结合时价电子层轨道是否要杂化?教科书上有一句话隐含了两个Cl通过p 2020-05-12 …
已知椭圆x^2/9+y^2=1,过左焦点F作倾斜角为30度的直线交椭圆于A,B两点求弦AB的长?这 2020-05-12 …
2道直线与方程的题1.直线L经过点p(2,-1),在x轴和y轴上的截距分别为a,b,且a=3b,求 2020-05-21 …
知道椭圆方程和直线方程,怎么求椭圆截得直线的长度只知道直线斜率.斜率为1,与椭圆x^2/4+y^2 2020-06-08 …
第一道:已知为正数,求证b^2/a+b^2/a>=a+b第二道:直线L过点P(3,2),倾斜角是直 2020-06-12 …
有400米跑道的运动场面积大约多少平方米?400米跑道的内圈面积多大?从题目中已知:8个跑道的运动 2020-07-17 …
化学除杂一直不懂,不知道用哪种物质,哪种方法才好.就想知道高中常见的物质除杂方法 2020-07-20 …
知道直线L过点P(-5,-4),且在x轴上和y轴上截距相等求直线方程~第二道题已知两点A(-1,-5 2021-01-06 …