早教吧作业答案频道 -->化学-->
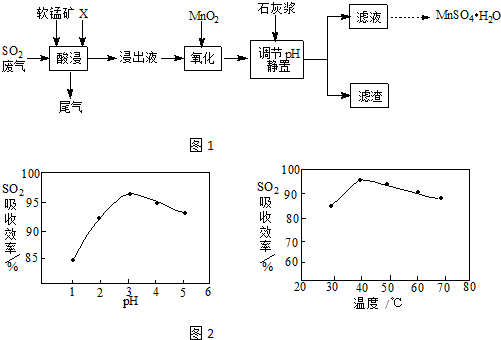
工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等)制备MnSO4•H2O的一种工艺流程如图1已知:1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2=MnSO42.浸出液中阳离子主要有Mn2+、Fe2+
题目详情
工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4•H2O 的一种工艺流程如图1
已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2=MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用 ___
a.盐酸b.硫酸c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如图2所示,为提高SO2的吸收效率,酸浸适宜的条件是___
(3)流程中“氧化”步骤主要反应的离子方程式是 ___
(4)加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去.检验Fe3+是否除尽的最佳方法是 ___.
(5)用MnSO4可测定水中溶解氧,方法是:取100mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3mol•L-1Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0mL时反应完全.有关化学反应方程式如下:
①2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
②MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③I2+2S2O32-=S4O62-+2I-.
计算水样中溶解氧的浓度(以mg•L-1为单位)___mg.L-1.

已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2=MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用 ___
a.盐酸b.硫酸c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如图2所示,为提高SO2的吸收效率,酸浸适宜的条件是___
(3)流程中“氧化”步骤主要反应的离子方程式是 ___
(4)加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去.检验Fe3+是否除尽的最佳方法是 ___.
(5)用MnSO4可测定水中溶解氧,方法是:取100mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3mol•L-1Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0mL时反应完全.有关化学反应方程式如下:
①2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
②MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③I2+2S2O32-=S4O62-+2I-.
计算水样中溶解氧的浓度(以mg•L-1为单位)___mg.L-1.
▼优质解答
答案和解析
(1)物质X最好选用硫酸,不引入杂质,故答案为:b;
(2)由图可知,提高SO2的吸收效率,酸浸适宜的条件为pH控制在3左右、温度控制在40℃左右,
故答案为:pH控制在3左右、温度控制在40℃左右;
(3)流程中“氧化”步骤主要反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)检验Fe3+是否除尽的最佳方法是取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽,
故答案为:取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽;
(5)n(S2O32-)=5.00×10-3mol•L-1×12.0 mL=6.00×10-5 mol,
O2~4 S2O32-
1 4
n(O2) 6.00×10-5 mol
n(O2)=
=1.50×10-5 mol,
水样中溶解氧的浓度为
=4.80 mg•L-1,
故答案为:4.80.
(2)由图可知,提高SO2的吸收效率,酸浸适宜的条件为pH控制在3左右、温度控制在40℃左右,
故答案为:pH控制在3左右、温度控制在40℃左右;
(3)流程中“氧化”步骤主要反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)检验Fe3+是否除尽的最佳方法是取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽,
故答案为:取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽;
(5)n(S2O32-)=5.00×10-3mol•L-1×12.0 mL=6.00×10-5 mol,
O2~4 S2O32-
1 4
n(O2) 6.00×10-5 mol
n(O2)=
| 1×6.00×10-5mol |
| 4 |
水样中溶解氧的浓度为
| 1.5×10-5mol×32g/mol×1000mg/g |
| 0.1L |
故答案为:4.80.
看了工业上用软锰矿(主要成分MnO...的网友还看了以下:
光化学烟雾的形成过程是:当汽车尾气产生的NO2在日光照射下分解成NO和O时,即开始光化学烟雾的循环 2020-05-12 …
如图表示由C、H、O三种化学元素组成的某种化合物的形成过程,下列叙述正确的是()A.若B是由两分子 2020-05-13 …
已知等位基因H、h及复等位基因ⅠA、ⅠB、i共同控制A、B、O血型形成过程如图.若小明的血型为O型 2020-06-12 …
如图表示以某种农作物①和②两个品种分别培育出不同品种的过程.请回答:(1)用①和②经过程Ⅰ、Ⅱ培育 2020-06-25 …
关于脂质中各种成分叙述正确的是A.磷脂是构成细胞膜的重要成分,在动物的脑、卵细胞、肝脏及大豆种子中 2020-07-03 …
有机物H(C9H10O2)是一种有茉莉花香味的无色油状液体,可用于配制香精,它的合成过程如下图所示。 2020-10-31 …
药物的萃取请问药物萃取的操作过程是怎样的?同时标明各具体要项(如:PH值和温度要保持在多少等)和操作 2020-11-05 …
书写电子式或用电子式回答下列问题①NaOH②H2O③O=C=O④CCl4⑤以氟化氢为例表示共价键形成 2020-11-28 …
黄豆种子的形成和萌发过程如图所示,下列说法正确的是()A.受精卵发育成①是胚B.②表示种子的形成过程 2021-02-01 …
黄豆种子的形成和萌发过程如图所示,下列说法正确的是()A.受精卵发育成①是胚B.②表示种子的形成过程 2021-02-01 …