早教吧作业答案频道 -->化学-->
物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:(1)基态Cu2+的电子排布式为,其最外电子层的电子数为.(2)利用价层电子对互斥理论(VSEPRtheory)预测多原子
题目详情
物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题: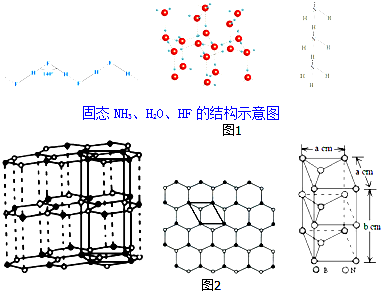
(1)基态Cu2+的电子排布式为___,其最外电子层的电子数为___.
(2)利用价层电子对互斥理论(VSEPR theory)预测多原子分子或离子立体构型时,认为价层电子间互斥力(F)的大小决定了夹角(∠)的大小:F(孤电子对间)>F(孤电子对-双键电子)>F(双键电子-单键电子)>F(单键电子间),则a.∠(孤-孤夹角)、b.∠(孤-双夹角)、c.∠(双-单夹角)、d.∠(单-单夹角)由大到小的排序为___(填编号);XeF4中Xe价层电子数为6对,画出其VSEPR模型(含中心原子的孤电子对)___.
(3)在图1中,除NH3、H2O、HF外的同主族氢化物的沸点随周期数增大而升高的原因是___;
已知固态NH3、H2O、HF的氢键键能和结构如表:
根据如表固态NH3、H2O、HF的结构示意图解释H2O、HF、NH3沸点依次降低的原因:___.
(4)石墨型BN呈白色,亦称“白石墨”,“白石墨”在一定条件下可转化为金刚石型BN.“白石墨”的结构示意图和晶胞如图2(中图是晶胞底面从“白石墨”中的截取情况),则“白石墨”的密度为___(以含a、b的代数式表示).

(1)基态Cu2+的电子排布式为___,其最外电子层的电子数为___.
(2)利用价层电子对互斥理论(VSEPR theory)预测多原子分子或离子立体构型时,认为价层电子间互斥力(F)的大小决定了夹角(∠)的大小:F(孤电子对间)>F(孤电子对-双键电子)>F(双键电子-单键电子)>F(单键电子间),则a.∠(孤-孤夹角)、b.∠(孤-双夹角)、c.∠(双-单夹角)、d.∠(单-单夹角)由大到小的排序为___(填编号);XeF4中Xe价层电子数为6对,画出其VSEPR模型(含中心原子的孤电子对)___.
(3)在图1中,除NH3、H2O、HF外的同主族氢化物的沸点随周期数增大而升高的原因是___;
已知固态NH3、H2O、HF的氢键键能和结构如表:
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
(4)石墨型BN呈白色,亦称“白石墨”,“白石墨”在一定条件下可转化为金刚石型BN.“白石墨”的结构示意图和晶胞如图2(中图是晶胞底面从“白石墨”中的截取情况),则“白石墨”的密度为___(以含a、b的代数式表示).
▼优质解答
答案和解析
(1)Cu是29号元素,原子核外电子数为29,Cu2+离子的电子排布式为:1s22s22p63s23p63d9,其M电子层的电子数为17,
故答案为:1s22s22p63s23p63d9;17;
(2)使得价层电子对间的孤电子对斥力最小,孤对电子间的排斥力较大,故键角由大到小为abcd,则XeF4分子中四个成键电子对处于同一平面上,两对孤对电子在上方和下方,理想构型为三角双锥形,VSEPR模型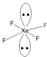 ,
,
故答案为:abcd; ;
;
(3)同主族氢化物一般都是分子晶体,除NH3、H2O、HF外,分子的相对分子质量越大,分子间的作用力越大,所以其沸点随周期数增大而升高,在NH3、H2O、HF中,氨分子只有一对孤电子对,氟化氢分子只有一个氢原子,水分子有两个氢原子和两对孤电子对,所以每摩尔氨气和氟化氢中都有1mol氢键,而每摩尔水中有2mol氢键,所以每摩尔水中含有氢键的键能为18.8kJ•mol-1×2=37.6kJ•mol-1,每摩尔NH3中含有氢键的键能为5.4kJ•mol-1,每摩尔HF中含有氢键的键能为28.1kJ•mol-1,每摩尔物所含氢键键能越大,即分子间作用力越大,则沸点越高,所以H2O、HF、NH3沸点由高到低的顺序依次为H2O>HF>NH3,
故答案为:同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大;单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n;
(4)根据石墨型BN的晶体结构可知,每个B原子周围有3个σ键、没有孤电子,所以B原子按sp2杂化,N原子周围有3个σ键,没有孤电子,在BN晶胞中含有原子数共为4×
+4×
+2×
+2×
+1+1=10,其中半是B原子,一半是N原子,由于晶胞的下底面为内角为60°的棱形,所以晶胞的体积为
a2b,根根据ρ=
可知,其密度为
g•cm-3=
g•cm-3,
故答案为:
g•cm-3.
故答案为:1s22s22p63s23p63d9;17;
(2)使得价层电子对间的孤电子对斥力最小,孤对电子间的排斥力较大,故键角由大到小为abcd,则XeF4分子中四个成键电子对处于同一平面上,两对孤对电子在上方和下方,理想构型为三角双锥形,VSEPR模型
 ,
,故答案为:abcd;
 ;
;(3)同主族氢化物一般都是分子晶体,除NH3、H2O、HF外,分子的相对分子质量越大,分子间的作用力越大,所以其沸点随周期数增大而升高,在NH3、H2O、HF中,氨分子只有一对孤电子对,氟化氢分子只有一个氢原子,水分子有两个氢原子和两对孤电子对,所以每摩尔氨气和氟化氢中都有1mol氢键,而每摩尔水中有2mol氢键,所以每摩尔水中含有氢键的键能为18.8kJ•mol-1×2=37.6kJ•mol-1,每摩尔NH3中含有氢键的键能为5.4kJ•mol-1,每摩尔HF中含有氢键的键能为28.1kJ•mol-1,每摩尔物所含氢键键能越大,即分子间作用力越大,则沸点越高,所以H2O、HF、NH3沸点由高到低的顺序依次为H2O>HF>NH3,
故答案为:同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大;单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n;
(4)根据石墨型BN的晶体结构可知,每个B原子周围有3个σ键、没有孤电子,所以B原子按sp2杂化,N原子周围有3个σ键,没有孤电子,在BN晶胞中含有原子数共为4×
| 1 |
| 12 |
| 1 |
| 6 |
| 1 |
| 3 |
| 1 |
| 6 |
| ||
| 2 |
| m |
| V |
| ||||
|
| 100 | ||
|
故答案为:
| 100 | ||
|
看了物质的结构决定物质的性质.请回...的网友还看了以下:
一个运行进程必须具有的3种基本状态是().A.就绪状态、挂起状态和执行状态B.挂起状态、阻塞状态和一 2020-03-31 …
组成DNA的碱基T被RNA中碱基U所代替,所以,T被大量利用是进行DNA复制 2020-05-14 …
在“检测不同环境中的细菌和真菌”的实验中,对培养基的叙述正确的是()A.培养基中可以不加入有机物B 2020-05-17 …
额度类消费贷款中,可执行的最低利率是:A.基准利率下浮5%B.基准利率C.基准利率上浮10%D.基准 2020-05-27 …
基极分压式共射放器中下偏电阻比射极电阻大,为什么说下偏中电流远大与基极静态电流如题还有为什么下偏电 2020-06-07 …
CpG岛相关为什么CpG如果是低甲基化状态就不会抑制基因的表达,而高甲基化状态会影响基因的表达?难 2020-06-29 …
DNA分子中的碱基C被氧化后会转变为碱基U,细胞中的一种糖苷酶能够识别出碱基U,将其切除,之后核酸内 2020-11-04 …
(10分)[环境保护湿地被誉为“地球之肾”,具有调蓄径流等多种基本生态效益。结合“三江平原沼泽率与垦 2020-11-26 …
DNA分子中的碱基C被氧化后会转变为碱基U,细胞中的一种糖苷酶能够识别出碱基U,将其切除,之后核酸内 2020-12-10 …
一种人工合成的mRNA上有两种碱基U和C,U为C的四倍,其中UCU密码子在所有密码子所占数量比为答案 2021-02-19 …