早教吧作业答案频道 -->化学-->
海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间.(1)①已知不同pH条件下,水溶液中碳元素的存在形态如图所
题目详情
海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间.
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如图所示.下列说法不正确的是___(填字母序号).
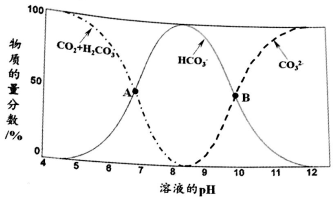
a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是___.
(2)海水pH稳定在7.9-8.4之间,可用于烟道气中CO2和SO2的吸收剂.
①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3.写出此反应的离子方程式:___.
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程的离子方程式是___.
(3)洗涤烟气后的海水呈酸性,需处理后再行排放.与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式.
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是___.
②上述方式使处理后海水pH升高的原因是___.
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如图所示.下列说法不正确的是___(填字母序号).

a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是___.
(2)海水pH稳定在7.9-8.4之间,可用于烟道气中CO2和SO2的吸收剂.
①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3.写出此反应的离子方程式:___.
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程的离子方程式是___.
(3)洗涤烟气后的海水呈酸性,需处理后再行排放.与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式.
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是___.
②上述方式使处理后海水pH升高的原因是___.
▼优质解答
答案和解析
(1)①a.图象分析可知,PH=8时主要存在的微粒是碳酸氢根离子,溶液中含碳元素的微粒主要是HCO3-,故a正确;
b.A点是碳酸氢根离子物质的量分数和二氧化碳的碳酸溶液中物质的量分数相同,溶液中H2CO3和HCO3-浓度不相同,故b错误;
c.图象分析可知当c(HCO3-)=c(CO32-)时,PH=10溶液显碱性,c(H+)-),故c错误;
故答案为:bc;
②pH=8.4的水溶液中主要是碳酸氢钠溶液,加入NaOH溶液时发生反应为碳酸氢钠和氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(2)①海水中钙离子在碱溶液中和二氧化碳反应生成碳酸钙沉淀和水,反应的离子方程式为:CO2+2OH-+Ca2+=CaCO3↓+H2O,
故答案为:CO2+2OH-+Ca2+=CaCO3↓+H2O;
②25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11,H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8,酸性强弱H2SO3 >H2CO3>HSO3->HCO3-,海水中含有的HCO3-可用于吸收SO2,反应生成生成二氧化碳和亚硫酸氢根离子,反应的离子方程式为:SO2+HCO3-=CO2+HSO3-,
故答案为:SO2+HCO3-=CO2+HSO3-;
(3)①洗涤烟气后的海水呈酸性是亚硫酸氢根离子电离大于其水解,通入O2可将酸性海水中的硫(IV)氧化生成硫酸根离子,反应的离子方程式为:O2+2HSO3-=2SO42-+2H+,
故答案为:O2+2HSO3-=2SO42-+2H+;
②上述方式使处理后海水pH升高的原因是与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2,
故答案为:与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2.
b.A点是碳酸氢根离子物质的量分数和二氧化碳的碳酸溶液中物质的量分数相同,溶液中H2CO3和HCO3-浓度不相同,故b错误;
c.图象分析可知当c(HCO3-)=c(CO32-)时,PH=10溶液显碱性,c(H+)
故答案为:bc;
②pH=8.4的水溶液中主要是碳酸氢钠溶液,加入NaOH溶液时发生反应为碳酸氢钠和氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(2)①海水中钙离子在碱溶液中和二氧化碳反应生成碳酸钙沉淀和水,反应的离子方程式为:CO2+2OH-+Ca2+=CaCO3↓+H2O,
故答案为:CO2+2OH-+Ca2+=CaCO3↓+H2O;
②25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11,H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8,酸性强弱H2SO3 >H2CO3>HSO3->HCO3-,海水中含有的HCO3-可用于吸收SO2,反应生成生成二氧化碳和亚硫酸氢根离子,反应的离子方程式为:SO2+HCO3-=CO2+HSO3-,
故答案为:SO2+HCO3-=CO2+HSO3-;
(3)①洗涤烟气后的海水呈酸性是亚硫酸氢根离子电离大于其水解,通入O2可将酸性海水中的硫(IV)氧化生成硫酸根离子,反应的离子方程式为:O2+2HSO3-=2SO42-+2H+,
故答案为:O2+2HSO3-=2SO42-+2H+;
②上述方式使处理后海水pH升高的原因是与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2,
故答案为:与新鲜海水混合起到稀释作用,鼓入空气排除了部分CO2.
看了海水中含有80多种元素,是重要...的网友还看了以下:
牧童吕岩草铺横野六七里,笛弄晚风三四声。归来饱饭黄昏后,不脱蓑衣卧月明。15.《牧童》一诗,向我们 2020-05-13 …
如图所示,在三个相同的容器中装有质量相同的水如图所示,在三个相同的容器中装有质量相同的水,将木块A 2020-05-17 …
第四套人民币10元纸币的水印图案是()。A.古钱满版水印B.农民头像固定水印C.工人头像固定水印 2020-05-27 …
固定台南门水印是第()套人民币采用的水印图案。A.二B.三C.四 2020-05-27 …
固定天安门水印是第()套人民币采用的水印图案。A.二B.三C.四 2020-05-27 …
有一只(水杯,题上是一个带柄的水杯图画),分别从前后左右观察它,请用连线将所观察到的图形连接起来. 2020-06-18 …
船模图纸比例怎么换算比如一个船的肋板的比例是1:200的它的水线图的比例是1:550的这样怎么把水 2020-07-02 …
如图所示,有4支相同材料、相同厚度的玻璃量筒,其中a.b.c等高,a,b粗细相同,c,d粗细相同.各 2020-11-07 …
建筑施工图中的水施图中,Gd/1、Wd/1、G/1、W/1表示什么? 2020-11-10 …
水是人类生存的根本,是社会生产最基本的资源之一。我国的“水”存在两大主要问题:一是水资源短缺,二是水 2020-11-26 …