早教吧作业答案频道 -->化学-->
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g
题目详情
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为.
(2)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2=___.
(3)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化.已知 2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H<0
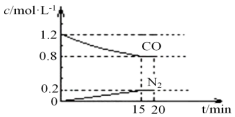
在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示.
①0~15min 内,v(CO2)=___,25℃时该反应平衡常数为___(该空保留2位小数);
②20min 时若改变反应条件,导致NO浓度下降,则改变的条件不可能是___(填选项序号).
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容积
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3.已知NaHSO3溶液同时存在以下两种平衡:
①HSO3-⇌SO32-+H+,②HSO3-+H2O⇌H2SO3+OH-;常温下,0.l mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3)___c(SO32-)(填“>”、“=”或“<”).

(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为.
(2)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2=___.
(3)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化.已知 2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H<0
在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示.
①0~15min 内,v(CO2)=___,25℃时该反应平衡常数为___(该空保留2位小数);
②20min 时若改变反应条件,导致NO浓度下降,则改变的条件不可能是___(填选项序号).
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容积
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3.已知NaHSO3溶液同时存在以下两种平衡:
①HSO3-⇌SO32-+H+,②HSO3-+H2O⇌H2SO3+OH-;常温下,0.l mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3)___c(SO32-)(填“>”、“=”或“<”).
▼优质解答
答案和解析
(1)已知1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,因此反应的热化学方程式为:CO(g)+
SO2(g)=
S(s)+CO2(g)△H=-135kJ/mol,故答案为:CO(g)+
SO2(g)=
S(s)+CO2(g)△H=-135kJ/mol;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×
可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1,则(-574KJ•mol-1+△H2)×
=-867KJ•mol-1,
解得△H2=-1160KJ/mol,
故答案为:-1160KJ/mol;
(3)①v(CO)=
=
=0.027 mol∙L-1∙min-1;所以v(CO2)=v(CO)=0.027 mol∙L-1∙min-1;
2NO(g)+2CO(g)⇌N2(g)+2CO2(g),
初起:1 1.2 0 0
变化:0.4 0.4 0.4 0.4
平衡:0.6 0.8 0.4 0.4
所以K=
=0.14,故答案为:0.027 mol∙L-1∙min-1; 0.14;
②a.升高温度平衡逆向移动,导致NO浓度增加,故符合; b.增加CO的量,平衡正向移动,导致NO浓度下降,故不符合; c.降低温度,平衡正向移动,导致NO浓度下降,故不符合; d.扩大容积平衡逆向移动,但导致NO浓度下降,故不符合;故选:a;
(4)已知NaHSO3中的HSO3-既能电离又能水 HSO3-⇌H++SO32-电离显酸性,HSO3-+H2O⇌H2SO3 +OH- 水解显碱性;常温下,0.1mol•L-1NaHSO3溶液的pH小于7,
说明电离大于水解,故:c(SO32-)>c(H2SO3),故答案为:<.
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×
| 1 |
| 2 |
| 1 |
| 2 |
解得△H2=-1160KJ/mol,
故答案为:-1160KJ/mol;
(3)①v(CO)=
| △c |
| △t |
| (1.2-0.8)mol/L |
| 15min |
2NO(g)+2CO(g)⇌N2(g)+2CO2(g),
初起:1 1.2 0 0
变化:0.4 0.4 0.4 0.4
平衡:0.6 0.8 0.4 0.4
所以K=
| 0.42×0.4 |
| 0.62×0.82 |
②a.升高温度平衡逆向移动,导致NO浓度增加,故符合; b.增加CO的量,平衡正向移动,导致NO浓度下降,故不符合; c.降低温度,平衡正向移动,导致NO浓度下降,故不符合; d.扩大容积平衡逆向移动,但导致NO浓度下降,故不符合;故选:a;
(4)已知NaHSO3中的HSO3-既能电离又能水 HSO3-⇌H++SO32-电离显酸性,HSO3-+H2O⇌H2SO3 +OH- 水解显碱性;常温下,0.1mol•L-1NaHSO3溶液的pH小于7,
说明电离大于水解,故:c(SO32-)>c(H2SO3),故答案为:<.
看了研究NOx、SO2、CO等大气...的网友还看了以下:
(七他上七•宝鸡三模)(上)已知:4(5)+O七(g)=4O七(g)△H=-393.5kJ/右ol 2020-04-07 …
硫酸的摩尔质量是多少g/mol,4g纯硫酸的物质的量是多少mol,其中氢元素质量是多少g,硫元素质 2020-05-16 …
公式:样品中的蛋白质含量(μg/g鲜重)={[查得的蛋白质含量(μg)] ×稀释倍数}/[样品鲜重 2020-05-17 …
同阶无穷小量的表示方法?急!还有f(x)=O(g(x))是什么意思?老师说f(x)=h(x)g(x 2020-06-05 …
某密闭容器中进行如下反应:X(g)+2Y(g)==2Z(g),若最初时只加X,Y两种物质,某密闭容 2020-06-07 …
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+3D(g 2020-06-07 …
请教一道关于无穷小量与无穷大量的比较的证明题o(g(x))+o(g(x))=o(g(x))(x-> 2020-06-14 …
将不同物质的量的H2O(g)和CO分别通入到1L某恒容密闭容器中进行反应:H2O(g)+CO(g) 2020-07-03 …
化学平衡状态的判断举例反应mA(g)+nB(g)⇌pC(g)+qD(g)平衡是否建立混合物体系中各 2020-07-14 …
H2SO4的相对分子质量为.196gH2SO4的物质的量是mol,分子数为,196gH2SO4中含 2020-07-18 …