早教吧作业答案频道 -->化学-->
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:(1)Cu位于元素周期表族.Cu2+的核外电子排布式为.(2)CuS
题目详情
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
(1)Cu位于元素周期表___ 族.Cu2+的核外电子排布式为___.
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___;CuSO4粉末常用来检验一些有机物中的微量水分,其原因是___.
(3)SO42-的立体构型是___,其中S原子的杂化轨道类型是___.
(4)Cu2O的熔点比Cu2S的___(填“高”或“低”),请解释原因___.
(5)往硫酸铜溶液中加入过量氨水,可生成2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___.
(6)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为___;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___;该晶体中,原子之间的作用力是___.
(7)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为___.
(1)Cu位于元素周期表___ 族.Cu2+的核外电子排布式为___.
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___;CuSO4粉末常用来检验一些有机物中的微量水分,其原因是___.
(3)SO42-的立体构型是___,其中S原子的杂化轨道类型是___.
(4)Cu2O的熔点比Cu2S的___(填“高”或“低”),请解释原因___.
(5)往硫酸铜溶液中加入过量氨水,可生成2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___.
(6)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为___;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___;该晶体中,原子之间的作用力是___.
(7)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为___.
▼优质解答
答案和解析
(1)铜是29号元素,位于周期表中第四周期,第ⅠB族,根据原子核外电子排布规律可写出Cu2+的核外电子排布式为1s22s22p63s23p63d9,
故答案为:ⅠB;1s22s22p63s23p63d9;
(2)加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O,白色无水硫酸铜可与水结合生成蓝色的CuSO4•5H2O,显示水合铜离子特征蓝色;
故答案为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O;白色无水硫酸铜可与水结合生成蓝色的CuSO4•5H2O;
(3)SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为:正四面体;sp3;
(4)氧离子的半径小于硫离子,半径越小,晶格能越大,物质的熔沸点就越高,所以Cu2O的熔点比Cu2S的高;
故答案为:高;半径越小,晶格能越大,物质的熔沸点就越高;
(5)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
故答案为:F的电负性大于N,NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键;
(6)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1,在晶胞中Cu原子处于面心,N(Cu)=6×
=3,Au原子处于顶点位置,N(Au)=8×
=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键;
故答案为:6s1;3:1;金属键;
(7)CaF2的结构如图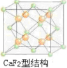 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
故答案为:Cu3AuH8.
故答案为:ⅠB;1s22s22p63s23p63d9;
(2)加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2 H2SO4(浓)
| ||
故答案为:Cu+2 H2SO4(浓)
| ||
(3)SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为:正四面体;sp3;
(4)氧离子的半径小于硫离子,半径越小,晶格能越大,物质的熔沸点就越高,所以Cu2O的熔点比Cu2S的高;
故答案为:高;半径越小,晶格能越大,物质的熔沸点就越高;
(5)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
故答案为:F的电负性大于N,NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键;
(6)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则最外层电子排布式为6s1,在晶胞中Cu原子处于面心,N(Cu)=6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:6s1;3:1;金属键;
(7)CaF2的结构如图
 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;故答案为:Cu3AuH8.
看了铜是重要金属,Cu的化合物在科...的网友还看了以下:
电镀时溶液中的阳离子会到阴极去得电子吗电镀时用的电解质是含度层金属的盐溶液.那他里面的阳离子不会到 2020-06-18 …
初一科学1.细胞核有什么作用?2.切开西瓜,流出的汁水,其主要成分为A.细胞质B.细胞核C.液泡D. 2020-12-06 …
某同学将少许红墨水滴到草履虫培养液中,几分钟后,取草履虫培养液制成临时装片在显微镜下观察,结果发现草 2020-12-14 …
西瓜.苹果.蕃茄等水果吃起来都具有各自特殊的味道,决定这些味道的物质存在于果肉细胞的()中.A.细胞 2020-12-14 …
切西瓜时,会流出一些汁液,这些汁液是从细胞的哪部分流出来的()A.细胞质B.细胞核C.液泡D.细胞膜 2020-12-14 …
炒苋菜时汤会变红,其红色物质主要来自于细胞的()A.细胞膜B.细胞核C.液泡 2020-12-14 …
吃西瓜时,会有很多甜液流出来.这些甜液主要来自西瓜细胞结构中的()A.细胞膜B.细胞核C.液泡内的细 2020-12-14 …
我们的溪蜜柚以皮薄多汁、清甜醇蜜、酸甜适中之优良品质而文明古今中外,而这些汁液来自细胞结构的哪一部分 2020-12-17 …
(2012•永安市模拟)洋葱具有特殊的气味,这种有气味的物质主要存在于()A.细胞质B.细胞核C.液 2020-12-22 …
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-=Cu+H2↑+2H2O+2HCOO-,下 2020-12-26 …