早教吧作业答案频道 -->化学-->
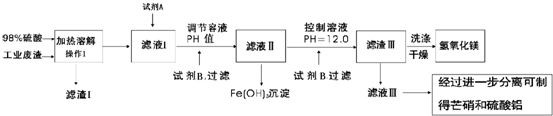
某工厂废渣含MgCO3、SiO2、Fe2O3、FeCO3和CaCO3、Al2O3.科研小组拟对废渣进行综合利用制取Mg(OH)2、芒硝(Na2SO4•10H2O)和Al2(SO4)3,设计如下工艺:下表为几种沉淀的相关数据.回答以下问题
题目详情
某工厂废渣含MgCO3、SiO2、Fe2O3、FeCO3和CaCO3、Al2O3.科研小组拟对废渣进行综合利用制取Mg(OH)2、芒硝(Na2SO4•10H2O)和Al2(SO4)3,设计如下工艺:
下表为几种沉淀的相关数据.回答以下问题:
(1)操作1名称是___,该操作中所用到的玻璃仪器有___.
(2)你认为在除铁过程中选用下列物质中的___(填序号)作为试剂A是最合适的,
a.KMnO4 b.O2 c.H2O2 d.Cl2
并用离子方程式表示往滤液I中加入试剂A的目的___.现采用滴定的方法测定废渣中FeCO3的含量,取m克该工厂废渣加足量的H2SO4溶解后配成VmL溶液,从中取出10mL倒入锥形瓶中进行滴定,用一定浓度的试剂A进行滴定,则盛放试剂A的滴定管应选用___(填“酸式”或“碱式”),滴定终了时消耗浓度为c mol•L-1的试剂A共b mL,则该废渣中FeCO3的质量分数为___.
(3)滤液Ⅱ中加入试剂B目的是除Mg2+,根据溶度积可知pH=10.8时Mg2+已除尽,控制溶液pH=12.0的目的是___,当pH=12.0时溶液中c(Mg2+)=___.
(4)欲从滤液Ⅲ中分离出Al2(SO4)3溶液,依次加入的试剂可以是___.___.

下表为几种沉淀的相关数据.回答以下问题:
| 物质名称 | 溶度积(Ksp) | pH | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)2 | 8.0×10-16 | 7.6 | 9.6 |
| Fe(OH)3 | 2.8×10-39 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
(2)你认为在除铁过程中选用下列物质中的___(填序号)作为试剂A是最合适的,
a.KMnO4 b.O2 c.H2O2 d.Cl2
并用离子方程式表示往滤液I中加入试剂A的目的___.现采用滴定的方法测定废渣中FeCO3的含量,取m克该工厂废渣加足量的H2SO4溶解后配成VmL溶液,从中取出10mL倒入锥形瓶中进行滴定,用一定浓度的试剂A进行滴定,则盛放试剂A的滴定管应选用___(填“酸式”或“碱式”),滴定终了时消耗浓度为c mol•L-1的试剂A共b mL,则该废渣中FeCO3的质量分数为___.
(3)滤液Ⅱ中加入试剂B目的是除Mg2+,根据溶度积可知pH=10.8时Mg2+已除尽,控制溶液pH=12.0的目的是___,当pH=12.0时溶液中c(Mg2+)=___.
(4)欲从滤液Ⅲ中分离出Al2(SO4)3溶液,依次加入的试剂可以是___.___.
▼优质解答
答案和解析
(1)根据题中流程可知,通过操作Ⅰ将不溶物和易溶物分离,通常使用过滤操作,过滤时需要使用的玻璃仪器有:烧杯、玻璃棒和漏斗,
故答案为:过滤;烧杯、玻璃棒、漏斗;
(2)根据表中溶度积可知,氢氧化亚铁完全沉淀时溶液的pH=9.6,与氢氧化镁完全沉淀的pH接近,不易直接除掉,需要用氧化剂氧化成铁离子,由于加入酸性高锰酸钾、氯水会引进杂质,氧气的氧化性较弱,氧化效果不好,所以最佳氧化剂为双氧水;
双氧水与亚铁离子反应的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O;
滴定10mL样品的溶液时消耗的双氧水的物质的量为:cmol/L×b×10-3L=cb×10-3mol,根据反应2H++2Fe2++H2O2=2Fe3++2H2O可知,亚铁离子的物质的量为:n(Fe2+)=n(FeCO3)=2n(H2O2)=2cb×10-3mol,则VmL样品溶液中含有FeCO3的物质的量为:2cb×10-3mol×
=2cbV×10-4mol,所以该样品中含有FeCO3的质量分数为:
×100%=
%,
双氧水能够氧化碱式滴定管的橡胶管,所以应该用酸式滴定管盛放双氧水;
故答案为:c;2H++2Fe2++H2O2=2Fe3++2H2O;酸式;
%;
(3)pH=10.8时Mg2+已除尽,控制溶液pH=12.0目的是使生成的Al(OH)3尽可能的溶解,便于获得较纯净的Mg(OH)2沉淀;
已知Ksp[Mg(OH)2]=5.6×10-12,当控制溶液pH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为:c(OH-)=
mol/L=10-2mol/L,Ksp(Mg(OH)2)=c(Mg2+)×c2(OH-)=5.6×10-12,c(Mg2+)=
=5.6×10-8mol•L-1,
故答案为:使生成的Al(OH)3尽可能的溶解,便于获得较纯净的Mg(OH)2沉淀;5.6×10-8mol•L-1;
(4)滤液Ⅲ中铝元素以偏铝酸根离子形式存在,可以通入过量二氧化碳气体转化成氢氧化铝沉淀,然后在加入稀硫酸将氢氧化铝转化成硫酸铝,所以需要的试剂分别为:CO2、稀硫酸,
故答案为:CO2;稀硫酸.
故答案为:过滤;烧杯、玻璃棒、漏斗;
(2)根据表中溶度积可知,氢氧化亚铁完全沉淀时溶液的pH=9.6,与氢氧化镁完全沉淀的pH接近,不易直接除掉,需要用氧化剂氧化成铁离子,由于加入酸性高锰酸钾、氯水会引进杂质,氧气的氧化性较弱,氧化效果不好,所以最佳氧化剂为双氧水;
双氧水与亚铁离子反应的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O;
滴定10mL样品的溶液时消耗的双氧水的物质的量为:cmol/L×b×10-3L=cb×10-3mol,根据反应2H++2Fe2++H2O2=2Fe3++2H2O可知,亚铁离子的物质的量为:n(Fe2+)=n(FeCO3)=2n(H2O2)=2cb×10-3mol,则VmL样品溶液中含有FeCO3的物质的量为:2cb×10-3mol×
| VmL |
| 10mL |
| 116g/mol×2cbV×10-3mol |
| mg |
| 23.2cbV |
| m |
双氧水能够氧化碱式滴定管的橡胶管,所以应该用酸式滴定管盛放双氧水;
故答案为:c;2H++2Fe2++H2O2=2Fe3++2H2O;酸式;
| 23.2cbV |
| m |
(3)pH=10.8时Mg2+已除尽,控制溶液pH=12.0目的是使生成的Al(OH)3尽可能的溶解,便于获得较纯净的Mg(OH)2沉淀;
已知Ksp[Mg(OH)2]=5.6×10-12,当控制溶液pH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为:c(OH-)=
| 10-14 |
| 10-12 |
| 5.6×10-12 |
| (10-2)2 |
故答案为:使生成的Al(OH)3尽可能的溶解,便于获得较纯净的Mg(OH)2沉淀;5.6×10-8mol•L-1;
(4)滤液Ⅲ中铝元素以偏铝酸根离子形式存在,可以通入过量二氧化碳气体转化成氢氧化铝沉淀,然后在加入稀硫酸将氢氧化铝转化成硫酸铝,所以需要的试剂分别为:CO2、稀硫酸,
故答案为:CO2;稀硫酸.
看了某工厂废渣含MgCO3、SiO...的网友还看了以下:
两地相距140千米,甲乙两人分别从两地同时出发相向而行,经过7/2小时相遇,甲每小时行15千米,乙 2020-05-20 …
1、甲行完AB两地的1/3需要2时,乙行完AB两地需要8时,如果甲乙分别从AB两地同时相向而行,经 2020-05-21 …
甲骑自行车,从A地出发,乙步行,从B地出发,俩人相向而行,经过2小时相遇,已知甲的速甲骑自行车,从 2020-05-23 …
像解决3x+4y=16和5x—6y=33这样的方程,为什么要用方程一和方程二分别乘上3和2然后为什 2020-06-13 …
列方程解应用题:1、甲乙两人骑自行车同时从相距65千米的两地相向而行,2小时相遇.甲:我每小时骑1 2020-07-02 …
√2分之1等于2分之√2?∠A=60°,SINA=a/c=√2分之1=2分之√2√2分之1=2分之 2020-07-03 …
AB两站间的路程为448km.AB两站间的路程为448km,一列慢车从A站出发,每小时行驶60km 2020-07-12 …
用方程解下列问题1.甲乙骑自行车同时从相距65千米的两地相向而行,2小时相遇,甲比乙每小时多骑2. 2020-07-19 …
相交线与平行线用式子表示下列句子:(1)因为∠1和∠2相等,根据“内错角相等,两直线平行”,所以A 2020-08-01 …
一道高二几何题1)一个直平行六面体,地面相邻边长为2根号2和5,它们的夹角为45度,这个平行六面体 2020-08-03 …