早教吧作业答案频道 -->化学-->
立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得.用含锌废料制取立德粉的实验流程如图:(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有
题目详情
立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得.用含锌废料制取立德粉的实验流程如图:
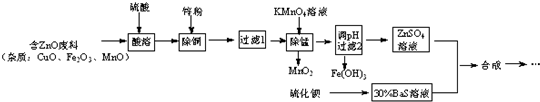
(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有___.
(2)加入锌粉被还原的离子有___.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是___.
(4)若所得ZnSO4酸性较强,可采取的简单措施是___.
(5)两种溶液合成立德粉,还需要经过陈化、___、___、___、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是___.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
实验中可选用的试剂:30% H2O2、3.0mol•L-1 H2SO4、1.0mol•L-1 NaOH.
实验步骤依次为:
①___;
②___;
③___;
④过滤得滤液.

(1)配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有___.
(2)加入锌粉被还原的离子有___.
(3)在弱酸性条件下,KMnO4除Mn2+时发生的离子反应是___.
(4)若所得ZnSO4酸性较强,可采取的简单措施是___.
(5)两种溶液合成立德粉,还需要经过陈化、___、___、___、焙烧、磨粉得成品.
(6)若最后发现立德粉成品白度不够,其可能原因是___.
(7)某研究性学习小组欲从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,再合成立德粉.请补充完整由废锌片制备ZnSO4溶液的实验步骤[如表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)].
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验步骤依次为:
①___;
②___;
③___;
④过滤得滤液.
▼优质解答
答案和解析
(1)配制30%BaS溶液需要及时称量固体质量溶解,搅拌等步骤,配制30%BaS溶液,现有量筒、烧杯及玻璃棒,还缺少的实验仪器有称量需要的托盘天平,
故答案为:托盘天平;
(2)含锌废料中加入硫酸溶解,加入锌粉还原溶解生成的铁离子和铜离子,加入锌粉被还原的离子有Fe3+、Cu2+,
故答案为:Fe3+、Cu2+;
(3)在弱酸性条件下,KMnO4除Mn2+时发生氧化还原反应生成二氧化锰,结合电荷守恒,原子守恒配平书写离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H +,
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H +;
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解,
故答案为:加少量的锌粉,搅拌直到溶解;
(5)立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得,生成的产物需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品,
故答案为:过滤、洗涤、干燥.
(6)立德粉成品白度不够,可能是含有有色金属离子,流程分析可能混入的杂质离子为铜离子、锰离子、铁离子等有色离子,在除杂过程中未除净,
故答案为:Cu2+、Mn2+及Fe3+没有除尽
(7)从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,需要除去杂质离子,金属单质需要溶于酸后调节溶液PH除去,因为制备的是硫酸锌,所以加入酸溶应为硫酸,溶解后过滤,得到滤液主要是硫酸锌和硫酸亚铁,依据沉淀完全需要的PH,应加入氧化剂过氧化氢氧化亚铁离子为铁离子,然后调节 溶液PH全部沉淀铁离子,锌离子不沉淀,达到除杂目的,实验步骤为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮,
②加入适量30% H2O2,使其充分反应,
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,
故答案为:用稍过量3.0 mol•L-1 H2SO4溶解废锌皮,加入适量30% H2O2,使其充分反应,1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
故答案为:托盘天平;
(2)含锌废料中加入硫酸溶解,加入锌粉还原溶解生成的铁离子和铜离子,加入锌粉被还原的离子有Fe3+、Cu2+,
故答案为:Fe3+、Cu2+;
(3)在弱酸性条件下,KMnO4除Mn2+时发生氧化还原反应生成二氧化锰,结合电荷守恒,原子守恒配平书写离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H +,
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H +;
(4)若所得ZnSO4酸性较强,可采取的简单措施是加少量的锌粉,搅拌直到溶解,
故答案为:加少量的锌粉,搅拌直到溶解;
(5)立德粉是一种白色颜料,可通过反应:ZnSO4(aq)+BaS(aq)═ZnS↓+BaSO4↓制得,生成的产物需要经过陈化、过滤、洗涤、干燥、焙烧、磨粉得成品,
故答案为:过滤、洗涤、干燥.
(6)立德粉成品白度不够,可能是含有有色金属离子,流程分析可能混入的杂质离子为铜离子、锰离子、铁离子等有色离子,在除杂过程中未除净,
故答案为:Cu2+、Mn2+及Fe3+没有除尽
(7)从废电池锌片 (主要成分为Zn、Fe、C)出发,先制备纯净的硫酸锌溶液,需要除去杂质离子,金属单质需要溶于酸后调节溶液PH除去,因为制备的是硫酸锌,所以加入酸溶应为硫酸,溶解后过滤,得到滤液主要是硫酸锌和硫酸亚铁,依据沉淀完全需要的PH,应加入氧化剂过氧化氢氧化亚铁离子为铁离子,然后调节 溶液PH全部沉淀铁离子,锌离子不沉淀,达到除杂目的,实验步骤为:
①用稍过量3.0 mol•L-1 H2SO4溶解废锌皮,
②加入适量30% H2O2,使其充分反应,
③1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全,
故答案为:用稍过量3.0 mol•L-1 H2SO4溶解废锌皮,加入适量30% H2O2,使其充分反应,1.0 mol•L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
看了立德粉是一种白色颜料,可通过反...的网友还看了以下:
把水或油灌入小口瓶时,常在瓶口插入一根竹筷或玻璃棒,水或油就沿着竹筷或玻璃棒流入瓶中,不致流到瓶子 2020-04-07 …
三圈环流和风带的关系三圈环流(哈德莱环流,费雷尔环流,极地环流)和风带(信风带,西风带,极地东风) 2020-04-27 …
找出错别字,依次写下来.下雨点狠狠地砸着玻璃.随着一阵噼噼啪啪的声响,窗户玻璃上流下-道道水痕.我 2020-05-14 …
‘之流’这个词有什么暗示意味有贬义的意思吗比如说刘德华之流当中之流表明对刘德华的轻视 2020-05-16 …
化学中用玻璃棒引流是什么原理?为什么水不会流走而是顺着玻璃棒流下? 2020-06-19 …
德邦物流是国家4A级企业,主营国内公路零担运输业务,服务网络遍及全国。读德邦公司运输流程图,回答下 2020-06-27 …
英语翻译SIS公司的王经理说他们的物流部门今天或明天会和德国物流公司取得联系并确认此事,然后直接通知 2020-11-28 …
(3分)把水或油灌入小口瓶时,常在瓶口插入一根竹筷或玻璃棒,水或油就沿着竹筷或玻璃棒流入瓶中,不致流 2021-01-13 …
用水或油灌入小口瓶时,常在瓶口插入一根竹筷或玻璃棒,水或油就沿着竹筷或玻璃棒流入瓶中,不致流到瓶子外 2021-01-13 …
把水或油灌入小口瓶时,常在瓶口插入一根竹筷或玻璃棒,水或油就沿着竹筷或玻璃棒流入瓶中,不致流到瓶子外 2021-01-13 …