早教吧作业答案频道 -->化学-->
(1)西班牙的瑞奥汀托河是一条酸河,河水中含有硫酸亚铁和硫酸.经调查发现,这是由于上游河床含有黄铁矿(FeS2,铁为+2价),在水中氧的作用下,发生了反应:2FeS2+7O2+2H2O═2FeSO4+2H2SO4
题目详情
(1)西班牙的瑞奥汀托河是一条酸河,河水中含有硫酸亚铁和硫酸.经调查发现,这是由于上游河床含有黄铁矿(FeS2,铁为+2价),在水中氧的作用下,发生了反应:2FeS2+7O2+2H2O═2FeSO4+2H2SO4.反应中FeS2是___剂,氧化产物是___,当有1molFeS完全反应时,转移的电子数___mol.
(2)某同学打算用稀硫酸与金属锌反应制备标准状况下的氢气224ml,为防止硫酸过量而造成浪费,实验中应需要硫酸___mol.实验室现有一瓶稀硫酸如图A所示,B为空瓶,若利用A瓶中的稀硫酸配制B瓶上标签所示稀硫酸200ml,需要准备的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和___,所需A瓶中稀硫酸的体积___.
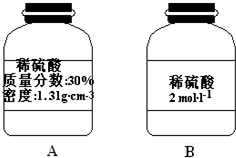
(2)某同学打算用稀硫酸与金属锌反应制备标准状况下的氢气224ml,为防止硫酸过量而造成浪费,实验中应需要硫酸___mol.实验室现有一瓶稀硫酸如图A所示,B为空瓶,若利用A瓶中的稀硫酸配制B瓶上标签所示稀硫酸200ml,需要准备的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和___,所需A瓶中稀硫酸的体积___.

▼优质解答
答案和解析
(1)FeS2完中Fe元素化合价不变,S元素化合价由-1价升高为硫酸、硫酸亚铁中的+6价,FeS2是还原剂,氧化产物是FeSO4、H2SO4,当有1mol FeS2完全反应时,转移的电子为1mol×2×[6-(-1)]=14mol,
故答案为:还原;FeSO4、H2SO4;14;
(2)Zn与硫酸反应生成硫酸锌与氢气,生成氢气为
=0.01mol,根据H原子守恒:n(H2SO4)=n(H2)=0.01mol,
还需要200mL容量瓶,需要硫酸的物质的量为0.2L×2mol/L=0.4mol,根据c=
可知,30%稀硫酸的物质的量浓度为
mol/L≈4mol/L,故需要30%硫酸的体积为
=0.1L=100.0mL,
故答案为:0.01;200mL容量瓶;100.0mL.
故答案为:还原;FeSO4、H2SO4;14;
(2)Zn与硫酸反应生成硫酸锌与氢气,生成氢气为
| 0.224L |
| 22.4L/mol |
还需要200mL容量瓶,需要硫酸的物质的量为0.2L×2mol/L=0.4mol,根据c=
| 1000ρω |
| M |
| 1000×1.31×30% |
| 98 |
| 0.4mol |
| 4mol/L |
故答案为:0.01;200mL容量瓶;100.0mL.
看了(1)西班牙的瑞奥汀托河是一条...的网友还看了以下:
一堆木料,底层有10根.顶层有2根,一共有5层.这对木料一共有多少根? 2020-03-31 …
排列组合问题有2个一分,4个五分,2个二十五分,5个一元,请问可以拼凑出多少个唯一的钱总数例如:用 2020-05-17 …
求教一个概率问题同时掷5枚骰子,其中有2对一样的概率是多少?这样解法对么?C(5,4)*C(4,2 2020-06-11 …
各位大哥大姐,本人急求助~帮忙解题,概率题,高悬赏,谢谢啦箱子里装有4个一级品与6个二级品,任取5 2020-06-14 …
排列组合问题有52张扑克牌,抽取其中5张,其中刚好有2个一对(即AA和55可以算作2个一对,KK和 2020-06-16 …
4个人夜里过一座独木桥,他们只有一只手电筒,一次最多可以有2人一起过桥,过桥时必须持有手电筒,所以 2020-06-19 …
根据要求写出相关诗句。1.苏轼的《江城子·密州出猎》文笔豪迈奔放,有江河一泻千里的气概,词中表达作 2020-06-20 …
成语中含有2个讹字的成语要有2个一个在第2个字上,一个在第4个字上 2020-06-21 …
有机化合物G是一种香精的调香剂,其合成路线如下:红外光谱分析,B分子结构中含有2个-CH3和2个- 2020-06-30 …
2只鸭子前面有2只,2只后面有2只,2只中间还有2只,一共有几只?6只有道理吗 2020-07-04 …