早教吧作业答案频道 -->化学-->
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)
题目详情
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
C6H12O6
b.CO2+3H2
CH3OH+H2O
c.CO2+CH4
CH3COOH
d.2CO2+6H2
CH2=CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是___(填序号).
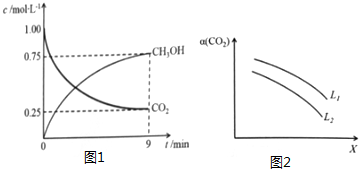
(2)CO2制备甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图1所示.
①该反应化学平衡常数K的表达式是___.
②0~9min时间内,该反应的平均反应速率v(H2)=___.
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是___(填字母序号).
a.0<Q<29.5kJ b.29.5kJ<Q<36.75kJ
c.36.75kJ<Q<49kJ d.49kJ<Q<98kJ
④在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强.
i.X压强的物理量是___.
ii.L1和L2的大小关系是___,简述理由:___.
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g)⇌CH3OH(g)△H1=-90.8kJ•mol-1
b.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
c.CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.3kJ•mol-1
①对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是___(填字母).
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
②总反应:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=___.
(4)以KOH溶液为电解质溶液,用二甲醚-空气组成燃料,其中负极的电极反应式为___.
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式___.
a.6CO2+6H2O
| 光合作用 |
| |
b.CO2+3H2
| 催化剂 |
| |
| △ |
c.CO2+CH4
| 催化剂 |
| |
| △ |
d.2CO2+6H2
| 催化剂 |
| |
| △ |
在以上属于人工转化的反应中,原子利用率最高的是___(填序号).
(2)CO2制备甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图1所示.
①该反应化学平衡常数K的表达式是___.
②0~9min时间内,该反应的平均反应速率v(H2)=___.
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是___(填字母序号).
a.0<Q<29.5kJ b.29.5kJ<Q<36.75kJ
c.36.75kJ<Q<49kJ d.49kJ<Q<98kJ
④在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强.
i.X压强的物理量是___.
ii.L1和L2的大小关系是___,简述理由:___.
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g)⇌CH3OH(g)△H1=-90.8kJ•mol-1
b.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
c.CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.3kJ•mol-1
①对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是___(填字母).
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
②总反应:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=___.
(4)以KOH溶液为电解质溶液,用二甲醚-空气组成燃料,其中负极的电极反应式为___.
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式___.

▼优质解答
答案和解析
(1)a.6CO2+6H2O
C6H12O6,是自然界中实现的转化,原子利用率100%,但不是人工转化,故a不符合;
b.CO2=3H2
CH3OH+H2O,反应中原子利用率不是100%,故b不符合;
c.CO2+CH4
CH3COOH,反应后原子利用率为100%,故c符合;
d.2CO2+6H2
CH2=CH2+4H2反应中原子利用率不是100%,故d不符合
故答案为:c;
(2)①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),该反应的平衡常数K=
,
故答案为:
;
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=
,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3×
=0.25mol/L•min,
故答案为:0.25mol/L•min;
③CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L-0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49KJ/mol×0.75mol=36.75KJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75KJ,则36.75<Q<49,
故答案为:c;
④CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应是气体体积减小的放热反应,
i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强,
故答案为:温度;
ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2,
故答案为:L1>L2;温度一定时,增大压强,CO2平衡转化率增大;
(3)①a.达到平衡时,物质的量不变,不是相等,故a错误;
b.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,压强始终不变,所以不能根据平衡体系的总压判断是否达到平衡状态,故b错误;
c.平衡时各物质的浓度不变,故c正确;
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1,符合正逆反应速率相等,故d正确;
故选cd,
故答案为:cd;
②a、2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
b、2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
c、CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过a×2+b+c可得所求热反应方程式,3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-90.8kJ•mol-1×2-23.5kJ•mol-1-41.3kJ•mol-1=-246.4kJ•mol-1;
故答案为:-246.4kJ•mol-1;
(4)燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为KOH,所以负极电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
(5)氮氧化物和一氧化碳反应生成氮气和二氧化碳,根据氮元素化合价变化,配平反应的方程式,反应的化学方�
| 光合作用 |
b.CO2=3H2
| 催化剂 |
| △ |
c.CO2+CH4
| 催化剂 |
| △ |
d.2CO2+6H2
| 催化剂 |
| △ |
故答案为:c;
(2)①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),该反应的平衡常数K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
故答案为:
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=
| 0.75mol/L |
| 9min |
| 0.75mol/L |
| 9min |
故答案为:0.25mol/L•min;
③CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L-0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49KJ/mol×0.75mol=36.75KJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75KJ,则36.75<Q<49,
故答案为:c;
④CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应是气体体积减小的放热反应,
i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强,
故答案为:温度;
ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2,
故答案为:L1>L2;温度一定时,增大压强,CO2平衡转化率增大;
(3)①a.达到平衡时,物质的量不变,不是相等,故a错误;
b.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,压强始终不变,所以不能根据平衡体系的总压判断是否达到平衡状态,故b错误;
c.平衡时各物质的浓度不变,故c正确;
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1,符合正逆反应速率相等,故d正确;
故选cd,
故答案为:cd;
②a、2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
b、2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
c、CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过a×2+b+c可得所求热反应方程式,3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-90.8kJ•mol-1×2-23.5kJ•mol-1-41.3kJ•mol-1=-246.4kJ•mol-1;
故答案为:-246.4kJ•mol-1;
(4)燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为KOH,所以负极电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
(5)氮氧化物和一氧化碳反应生成氮气和二氧化碳,根据氮元素化合价变化,配平反应的方程式,反应的化学方�
看了随着能源与环境问题越来越被人们...的网友还看了以下:
英语翻译微博作为一种迷你型博客,是一种新兴的信息传播工具.发布微博不超过140个字,随时随地更新发 2020-05-14 …
阅读材料,.随着草原环境的变化、草原人口的增加、过度的放牧,现在,在内蒙古自治区的草原上已经看不到 2020-06-12 …
随笔随笔我要三千字的随笔,越多越好.是初中生的. 2020-06-29 …
阅读下面科普短文.随着环境意识的提高,人们对室内空气质量越来越关心.下表列举了室内空气的主要污染物及 2020-10-31 …
基因频率总在不断改变的原因为什么没“环境多变”“基因突变、基因重组和自然选择”是正确答案,可我觉得随 2020-11-03 …
我国的中医博大精深,越来越受到人们的关注。但随着环境、人的体质、生活方式、药材性状等都与过去发生很多 2020-12-03 …
2013年3月13日,中国海监西沙巡查编队在执行例行巡查任务时,发现2艘越南非法越境捕捞渔船并对其进 2020-12-07 …
我在一本参考书上看到的一句汉译英原题,我有点疑问,制定这项制度是为了缓解交通和解决上下班的乘车的问题 2020-12-14 …
我国的中医博大精深,越来越受到人们的关注。但随着环境、人的体质、生活方式、药材性状都与过去发生很大变 2020-12-22 …
下列关于种群以“S”型曲线增长的叙述正确的是()A.各阶段的增长速率不同,随着时间的增加越来越大B. 2020-12-31 …