早教吧作业答案频道 -->化学-->
(一)五种元素的原子电子层结构如下:A.1s22s1;B.1s22s22p4;C.1s22s22p6;D.1s22s22p63s23p2;E.[Ar]3d104s1.[用元素符号作答](1)元素的第一电离能最大的是;(2)属于过渡元素的是;
题目详情
(一)五种元素的原子电子层结构如下:A.1s22s1;B.1s22s22p4;C.1s22s22p6; D.1s22s22p63s23p2;E.[Ar]3d104s1.[用元素符号作答]
(1)元素的第一电离能最大的是___;
(2)属于过渡元素的是___;
(3)元素的电负性最大的是___;
(4)上述元素之间能形成X2Y型化合物的化学式是___和___.
(二) A、B、C、D、E代表5种元素.请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为___;
(2)D元素的正三价离子的3d能级为半充满,D的元素符号为___,其基态原子的外围电子排布图为___.
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,由E元素形成的晶体采用___堆积,其晶胞空间利用率为___.
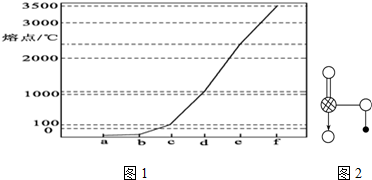
(三)如图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.
(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含___个σ键,___个π键.
(2)a与b的元素形成的10电子中性分子X的空间构型为___;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到配离子的化学式为___,其中X与Ag+之间以___键结合.
(3)氢键的形成对物质的性质具有一定的影响.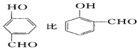 的沸点___.(填高或低)
的沸点___.(填高或低)
(4)如图2是上述六种元素中的一种元素形成的最高价含氧酸的结构:请简要说明该物质易溶于水的两个原因:___.

(1)元素的第一电离能最大的是___;
(2)属于过渡元素的是___;
(3)元素的电负性最大的是___;
(4)上述元素之间能形成X2Y型化合物的化学式是___和___.
(二) A、B、C、D、E代表5种元素.请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为___;
(2)D元素的正三价离子的3d能级为半充满,D的元素符号为___,其基态原子的外围电子排布图为___.
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,由E元素形成的晶体采用___堆积,其晶胞空间利用率为___.
(三)如图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.
(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含___个σ键,___个π键.
(2)a与b的元素形成的10电子中性分子X的空间构型为___;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到配离子的化学式为___,其中X与Ag+之间以___键结合.
(3)氢键的形成对物质的性质具有一定的影响.
 的沸点___.(填高或低)
的沸点___.(填高或低)(4)如图2是上述六种元素中的一种元素形成的最高价含氧酸的结构:请简要说明该物质易溶于水的两个原因:___.
▼优质解答
答案和解析
(一)由核外电子排布式可知,A为Li、B为O、C为Ne、D为Si、E为Cu;
(1)稀有气体Ne的第一电离能最大,故答案为:Ne;
(2)Cu属于过渡元素,故答案为:Cu;
(3)上述元素中O元素非金属性最强,故O元素电负性最大,故答案为:O;
(4)元素之间能形成X2Y型化合物为Li2O、Cu2O,故答案为:Li2O、Cu2O;
(二)(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该元素为N元素,故答案为:N;
(2)D元素的正三价离子的3d能级为半充满,基态原子外围电子排布为3d64s2,D为Fe,价电子排布图为,
故答案为:Fe;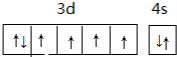 ;
;
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子外围电子排布为3d604s1,则E为Cu,为面心立方最密堆积,空间利用率为74%,
故答案为:面心立方最密;74%;
(三)在给出的元素中,c、d均是热和电的良导体,二者为金属,再结合图一,d的熔点比c的高,可知d为Cu,c为Na,由单质的熔点高低的顺序可知a为氢气,b为氮气,e为Si,f为碳单质.
(1)a、f对应的元素以原子个数比1:1形成的分子为乙炔,乙炔分子中含有2个C-H键和1个-C≡C-,C-H键为δ键,-C≡C-中有1个δ键,2个π键,所以乙炔分子含有3个δ键,2个π键,
故答案为:3; 2;
(2)a与b的元素形成的10电子中性分子X为NH3,空间构型为三角锥型.氨气与AgNO3溶液生成[Ag(NH3)2]+.Ag+提供空轨道,氨气分子提供孤对对子,通过配位键形成[Ag(NH3)2]+,
故答案为:三角锥形;[Ag(NH3)2]+,配位;
(3)前者形成分子间氢键,增大物质熔沸点,而后者分子内氢键,降低物质熔沸点,故前者熔沸点更高,故答案为:高;
(4)根据图二可知该酸为HNO3,HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的-OH易与水分子之间形成氢键,
故答案为:HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的-OH易与水分子之间形成氢键.
(1)稀有气体Ne的第一电离能最大,故答案为:Ne;
(2)Cu属于过渡元素,故答案为:Cu;
(3)上述元素中O元素非金属性最强,故O元素电负性最大,故答案为:O;
(4)元素之间能形成X2Y型化合物为Li2O、Cu2O,故答案为:Li2O、Cu2O;
(二)(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该元素为N元素,故答案为:N;
(2)D元素的正三价离子的3d能级为半充满,基态原子外围电子排布为3d64s2,D为Fe,价电子排布图为,
故答案为:Fe;
 ;
;(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子外围电子排布为3d604s1,则E为Cu,为面心立方最密堆积,空间利用率为74%,
故答案为:面心立方最密;74%;
(三)在给出的元素中,c、d均是热和电的良导体,二者为金属,再结合图一,d的熔点比c的高,可知d为Cu,c为Na,由单质的熔点高低的顺序可知a为氢气,b为氮气,e为Si,f为碳单质.
(1)a、f对应的元素以原子个数比1:1形成的分子为乙炔,乙炔分子中含有2个C-H键和1个-C≡C-,C-H键为δ键,-C≡C-中有1个δ键,2个π键,所以乙炔分子含有3个δ键,2个π键,
故答案为:3; 2;
(2)a与b的元素形成的10电子中性分子X为NH3,空间构型为三角锥型.氨气与AgNO3溶液生成[Ag(NH3)2]+.Ag+提供空轨道,氨气分子提供孤对对子,通过配位键形成[Ag(NH3)2]+,
故答案为:三角锥形;[Ag(NH3)2]+,配位;
(3)前者形成分子间氢键,增大物质熔沸点,而后者分子内氢键,降低物质熔沸点,故前者熔沸点更高,故答案为:高;
(4)根据图二可知该酸为HNO3,HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的-OH易与水分子之间形成氢键,
故答案为:HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的-OH易与水分子之间形成氢键.
看了 (一)五种元素的原子电子层结...的网友还看了以下:
以知集合A={s|s=t^2-1,t属于R},B={(t,s)|s=t^2-1,t属于R},则A并B 2020-03-30 …
如图所示,两根足够长电阻不计的光滑导轨MM′和NN′间距为L=0.1m与水平方向成θ=30°角,M 2020-05-17 …
如图所示,两根金属导轨平行放置在倾角为θ=30°的斜面上,导轨左端接有电阻R=8Ω,导轨自身电阻不 2020-05-17 …
氧化物成为氯化物一个化合价为2的金属氧化物,成为氯化物,就他的化学方程式? 2020-06-03 …
水平面上有电阻不计的U形导轨NMPQ,它们之间的宽度为L=1m,M和P之间接入电动势为E=10V的 2020-06-05 …
关于归中反应.H2S+H2SO4(浓)===S+SO2+2H2O是归中反应吗?为什么不是+2的S变 2020-06-13 …
由二氧化锰制备金属锰是否能自发进行快!由二氧化锰制备金属锰可采取下列两种方法:(1)MnO2(s) 2020-06-14 …
1.为抗击旱灾,凤岭小学新建一个圆柱体水窖,底面周长12.56米,深5米.爱心送水车送来60米3饮 2020-06-21 …
水平面上有电阻不计的U形导轨NMQP,它们之间的宽度为L=1m,M和P之间接入电动势为E=10V的 2020-06-27 …
水平面上有电阻不计的U形导轨NMPQ,它们之间的宽度为L=1m,M和P之间接入电动势为E=10V的 2020-06-27 …