早教吧作业答案频道 -->化学-->
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d(n+6)ns1.由它们组成的配位化合物X
题目详情
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
(1)该配位化合物X的化学式为___.
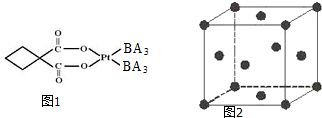
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图1,其中碳原子的杂化方式有___.
(3)D元素原子的最外层电子轨道表式为___.
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为___.
(5)元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2),氰氨化钙和水反应可生成NH3.与CN22-互为等电子体的分子有___(填写一种化学式即可);写出CaCN2水解反应的化学方程式___.
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式___.单质E的晶胞如图2所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为ρ=___g/cm3.

(1)该配位化合物X的化学式为___.
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图1,其中碳原子的杂化方式有___.
(3)D元素原子的最外层电子轨道表式为___.
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为___.
(5)元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2),氰氨化钙和水反应可生成NH3.与CN22-互为等电子体的分子有___(填写一种化学式即可);写出CaCN2水解反应的化学方程式___.
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式___.单质E的晶胞如图2所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为ρ=___g/cm3.
▼优质解答
答案和解析
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,符合条件的只有O和S元素,则C是O元素、D是S元素;
B的第一电离能大于C,而原子序数小于C,则B是N元素;
E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,
(1)通过以上分析知,X为[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O;
(2)碳铂分子中C原子的价层电子对个数有的是3有的是4,所以该分子中C原子杂化方式为sp2杂化和sp2杂化,故答案为:sp2杂化和sp2杂化;
(3)D是S元素,S元素原子的最外层电子为3s、3p电子,3s轨道有2个电子、3p轨道有4个电子,其最外层电子排布图为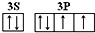 ,故答案为:
,故答案为: ;
;
(4)氢键的存在导致物质溶解性增大,H和O元素组成的水和双氧水之间能形成氢键,所以二者能以任意比互溶,故答案为:H2O与H2O2之间形成氢键;
(5)价层电子数相等、原子个数相等的微粒互为得电子体,则与CN22-互为等电子体的分子有CO2或N2O;碳化钙和水反应生成乙炔和氢氧化钙,则CaCN2和水反应方程式为CaCN2+3H2O=CaCO3+2NH3↑,故答案为:CO2或N2O; CaCN2+3H2O=CaCO3+2NH3↑;
(6)H元素与Cu元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物为CuH,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),即生成硝酸铜、氢气、NO和水,反应方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
该晶胞的体积为a3cm3,根据ρ=
=
g/cm3=
g/cm3,故答案为:6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
.
B的第一电离能大于C,而原子序数小于C,则B是N元素;
E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,
(1)通过以上分析知,X为[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O;
(2)碳铂分子中C原子的价层电子对个数有的是3有的是4,所以该分子中C原子杂化方式为sp2杂化和sp2杂化,故答案为:sp2杂化和sp2杂化;
(3)D是S元素,S元素原子的最外层电子为3s、3p电子,3s轨道有2个电子、3p轨道有4个电子,其最外层电子排布图为
 ,故答案为:
,故答案为: ;
;(4)氢键的存在导致物质溶解性增大,H和O元素组成的水和双氧水之间能形成氢键,所以二者能以任意比互溶,故答案为:H2O与H2O2之间形成氢键;
(5)价层电子数相等、原子个数相等的微粒互为得电子体,则与CN22-互为等电子体的分子有CO2或N2O;碳化钙和水反应生成乙炔和氢氧化钙,则CaCN2和水反应方程式为CaCN2+3H2O=CaCO3+2NH3↑,故答案为:CO2或N2O; CaCN2+3H2O=CaCO3+2NH3↑;
(6)H元素与Cu元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物为CuH,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),即生成硝酸铜、氢气、NO和水,反应方程式为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
该晶胞的体积为a3cm3,根据ρ=
| m |
| V |
| ||
| a3 |
| 4M |
| NA×a3 |
| 4M |
| NA×a3 |
看了前四周期的五种元素A、B、C、...的网友还看了以下:
下列说法中错误的是()①化学性质相似的有机物是同系物②分子组成相差一个或几个CH2原子团的有机物是 2020-05-14 …
下列说法中正确的是①化学性质相似的有机物是同系物②分子组成相差一个或几个CH2原子团的有机物是同系 2020-05-14 …
下列说法中错误的是()①化学性质相似的有机物是同系物②分子组成相差一个或几个CH2原子团的有机物是 2020-05-14 …
H2O和H2O2含有相同的元素组成,但它们的化学性质相差甚远,下列关于H2O和H2O2的说法,不正 2020-05-14 …
请问区分物质的最低层的依据是什么;区分不同原子的依据是什么.原子由质子和电子构成;比如氧原子与氢原 2020-05-15 …
什么的,在元素周期表中的第14组的元素都有一个共同点?他们是金属.他们是在同一时期.他们有相同数量 2020-06-09 …
在异步电机或者同步电机中,定子的交流绕组部分,为什么短距绕组两边感应电动势大小相等,只是相位不同呢 2020-07-30 …
求七个字组成的两个句子或者对联如题找七个字组成的句子或对联两个条件是两句中开头和结尾的字都相同(它们 2020-11-03 …
家长们赞同孩子们的课外活动吗? 2020-12-21 …
语文三年级好[似]他乐得像个孩子[似]的分别读哪个音?句子填空(,)我们小组全体同学(.),我们小组 2020-12-22 …