早教吧作业答案频道 -->化学-->
已知反应AsO43-+2I-+H+⇌AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现
题目详情
已知反应AsO43-+2I-+H+⇌AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现微安培表指针向前述相反方向偏转.试回答:
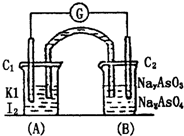
(1)两次操作过程中指针为什么会发生偏转?
(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.
(3)(Ⅰ)操作过程中C1棒上发生的反应为___.
(4)(Ⅱ)操作过程中C2棒上发生的反应为___.
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现微安培表指针向前述相反方向偏转.试回答:

(1)两次操作过程中指针为什么会发生偏转?
(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.
(3)(Ⅰ)操作过程中C1棒上发生的反应为___.
(4)(Ⅱ)操作过程中C2棒上发生的反应为___.
▼优质解答
答案和解析
由图可知,该装置为原电池,(Ⅰ)发生AsO43-+2I-+2H+⇌AsO33-+I2+H2O,C1棒为负极,电极反应发生2I--2e-=I2;
(Ⅱ)发生AsO33-+I2+2OH-⇌AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,
(1)因两次操作过程均能形成原电池,都是把化学能转化为电能,形成电流指针偏转,
故答案为:这是原电池,指针偏转是由于电子流过电流表 ;
;
(2)B中加盐酸,AsO43-发生得电子反应;而当加入NaOH后,AsO33-发生失电子反应,为负极,则指针偏转方向不同,
故答案为:B中加盐酸,AsO43-发生得电子反应;而当加入NaOH后,AsO33-发生失电子反应,为负极;
(3)C1棒为负极,电极反应发生2I--2e-=I2,
故答案为:2I--2e-=I2;
(4)C2棒为负极,电极反应为AsO33--2e-+H2O=AsO43-+2H+,
故答案为:AsO33--2e-+H2O=AsO43-+2H+.
(Ⅱ)发生AsO33-+I2+2OH-⇌AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,
(1)因两次操作过程均能形成原电池,都是把化学能转化为电能,形成电流指针偏转,
故答案为:这是原电池,指针偏转是由于电子流过电流表
 ;
; (2)B中加盐酸,AsO43-发生得电子反应;而当加入NaOH后,AsO33-发生失电子反应,为负极,则指针偏转方向不同,
故答案为:B中加盐酸,AsO43-发生得电子反应;而当加入NaOH后,AsO33-发生失电子反应,为负极;
(3)C1棒为负极,电极反应发生2I--2e-=I2,
故答案为:2I--2e-=I2;
(4)C2棒为负极,电极反应为AsO33--2e-+H2O=AsO43-+2H+,
故答案为:AsO33--2e-+H2O=AsO43-+2H+.
看了已知反应AsO43-+2I-+...的网友还看了以下:
已知,一个可逆反应,若正反应为自发过程,则其逆反应为非自发过程,反之,亦然。(1)已知2CO(g) 2020-05-01 …
如果一个反应当反应物的物质的量为n时,放出热量为Q,哪么当反应物的物质的量为2n时,放出的热量为多 2020-05-13 …
盐的水解可以看成是中和反应的逆反应不也就是说盐水解的过程也在发生着酸碱中和吗那为什么盐的水解要写可 2020-05-14 …
在恒压容器中发生可逆反应:N2+O2=2NO(为可逆反应.可逆符号打不出来),若往容器中充入He, 2020-06-17 …
可确认发生化学平衡移动的是()A.平衡常数发生了改变B.有气态物质参加的可逆反应达到平衡后,改变了 2020-07-05 …
已知,一个可逆反应,若正反应为自发过程,则其逆反应为非自发过程,反之,亦然。(1)已知2CO(g) 2020-07-09 …
将固体NH4I置于密闭容器中,在某温度下发生下列反应``可逆反应NH4I(s)=NH3(g)+HI( 2020-10-30 …
关于化学电源的说法不正确的是()A.充电电池可重复使用是因为所发生的反应可逆向进行B.充电电池工作时 2020-12-15 …
1.可以作为判断化学平衡发生移动的标志是A反应混合物各组分浓度发生改变B正逆反应速率发生改变C反应物 2021-01-22 …
能确认化学平衡一定发生移动的是()A.化学反应速率发生了改变B.可逆反应达到平衡后,使用催化剂C.有 2021-01-22 …